Explicamos o que é uma ligação química e os tipos que existem. Além disso, quais são suas principais características e alguns exemplos.

O que é uma ligação química?
É chamada de ligação química a combinação entre átomos, moléculas ou íons que formam compostos mais complexos dotados de estabilidade, alterando suas propriedades físicas e químicas. Uma vez unidos, dois ou mais átomos constituem um composto químico.
os átomos eles tendem a se unir para alcançar condições mais estáveis do que sozinhoscomplementando suas cargas elétricas por meio do compartilhamento de elétrons de sua órbita atômica mais externa, bem como cedendo ou aceitando elétrons para formar íons (positivos ou negativos) que são atraídos eletrostaticamente entre si.
Isso ocorre porque os prótons no núcleo atômico são carregados positivamente e os elétrons ao seu redor são carregados negativamente, de modo que os átomos tendem a ser configurados da forma mais neutra possível.
Existem diferentes tipos de ligações químicas, dependendo do tipo de átomos ligados, que possuem mecanismos próprios e peculiares de ligação: até agora ligações covalentes, iônicas e metálicas são conhecidas e aceitas mas há outras teorias e aproximações.
Veja também: Alcenos
Tipos de ligação química
Existem três tipos principais de ligação química:
- Ligação covalente. Ocorre quando átomos não metálicos de eletronegatividades semelhantes (geralmente altas) se juntam para compartilhar elétrons de sua última órbita e formar um composto químico estável.
- ligação iônica. Consiste na união de átomos metálicos e não metálicos, através de uma transferência de elétrons do metal para o não metal. Assim, formam-se íons eletricamente carregados, cátions (+) e ânions (-), que se atraem eletrostaticamente, constituindo a ligação e formando os diferentes compostos químicos iônicos. Os átomos que formam esse tipo de ligação possuem uma grande diferença de eletronegatividade.
- ligação metálica. É aquela que ocorre entre os átomos metálicos de um mesmo elemento em seu estado sólido, que constituem estruturas extremamente compactas e próximas entre si. É uma ligação primária e forte, na qual os núcleos atômicos se unem rodeados por seus elétrons como em uma nuvem.
Características de uma ligação química
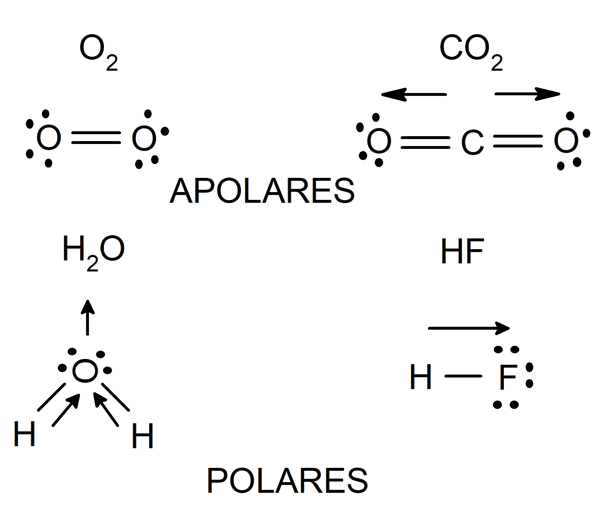
Polaridade
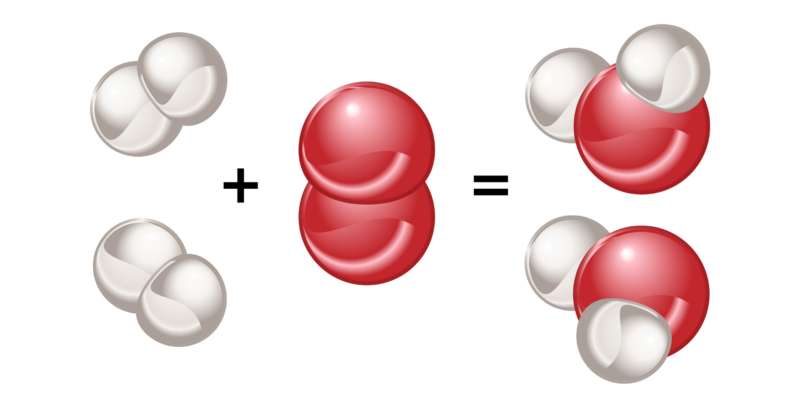
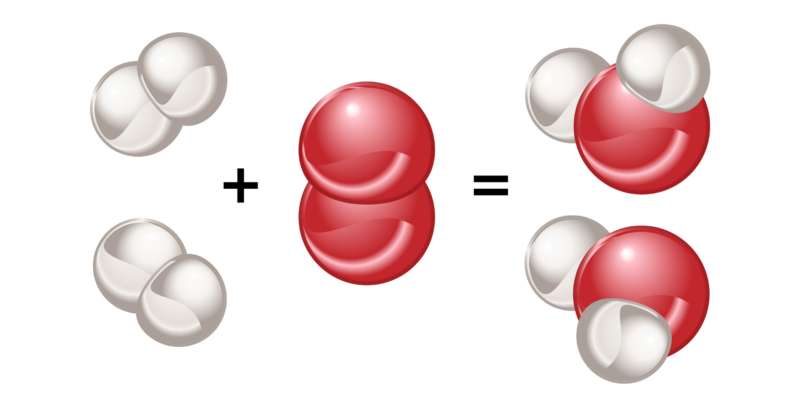
A polaridade é uma característica das moléculas formadas por ligações covalentes, e depende diretamente da natureza dos átomos ligados.
Se dois átomos do mesmo elemento se ligam, não haverá diferença entre a eletronegatividade de cada um. Dessa forma, o par de elétrons que eles compartilham será atraído por cada um desses átomos com a mesma força, de modo que a distribuição de cargas elétricas será uniforme na molécula que eles formam.
a mesma coisa acontece quando átomos de diferentes elementos se ligam, mas cuja diferença de eletronegatividade é muito pequena (menos de 0,4). As moléculas formadas dessa maneira são chamadas de ‘apolares ou apolares’ e esse tipo de ligação é chamada de ‘ligação covalente apolar’.
Por outro lado, se estiverem ligados dois átomos de elementos diferentes, e a diferença de eletronegatividade entre eles é maior que 0,4, então o átomo mais eletronegativo atrai os elétrons ligantes para si com maior força, gerando uma distribuição de carga não uniforme na estrutura da molécula que eles formam. As moléculas formadas por este processo são denominadas ‘polares’ e este tipo de ligação ‘ligação covalente polar’.

eletrovalência
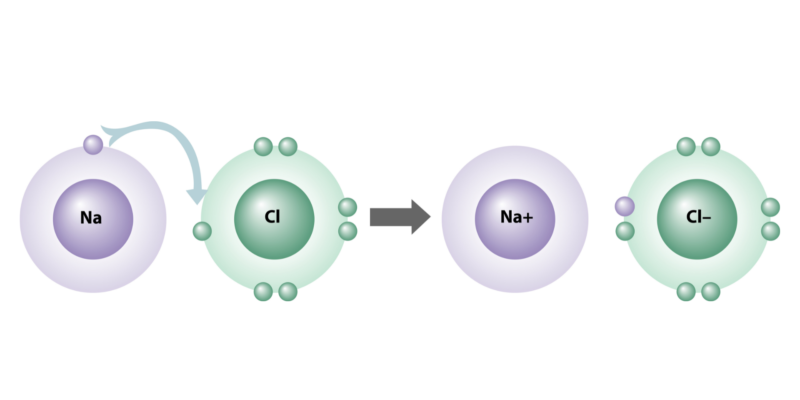

As ligações iônicas são caracterizadas por seus átomos têm uma grande diferença de eletronegatividade (maior que 2)na medida em que um perde e o outro recebe elétrons ao se juntar.
Essa capacidade elétrica dos átomos é conhecida como eletrovalência, já que alguns elementos são naturalmente mais propensos a serem “doadores” de elétrons (grupos IA, IIA, IIIA da tabela periódica) e outros tendem a ser, ao contrário, “aceptores”. ” ( grupos VA, VIA e VIIA).
mar de elétrons
É chamado de “mar de elétrons” Fenômeno que ocorre entre átomos metálicos do mesmo tipo que estão sujeitos entre si por ligações metálicas. Pode-se ver como se os núcleos atômicos estivessem imersos em um mar de seus elétrons.
Os metais têm baixa eletronegatividade, são brilhantes e maleáveis.condições que se devem à natureza da ligação que os mantém unidos em seu estado sólido: uma ordem rígida que desloca os elétrons de valência de seus orbitais, permitindo grande condução de eletricidade e calor, e a capacidade de retornar quase a totalidade do luz que os atinge.
quebrando ligações químicas


As ligações químicas podem ser quebradas sob certas condições. quando submetido à ação do caloreletricidade ou outras substâncias que quebrem a união e permitam a liberação dos átomos envolvidos.
Assim, por exemplo, ao aplicar eletricidade para água pode separar hidrogênio e oxigênio que o compõem em um processo denominado “eletrólise”. Por outro lado, aumentar muito a temperatura (fornecendo calor) de uma proteína pode desnaturá-la e quebrar suas ligações constitutivas.
ligações de hidrogênio
Uma ligação de hidrogênio é a união de um átomo eletronegativo com um átomo de hidrogênio que, por sua vez, está ligado covalentemente a outro átomo eletronegativo, formando uma “ponte” entre dois átomos que normalmente não poderiam se unir.
É, no entanto, um tipo de ligação de força fraca, mas que permite a composição de moléculas complexas, conferindo-lhes grande estabilidade, tanto em substâncias orgânicas como inorgânicas.
Existem também pontes de hidrogênio entre diferentes moléculas do mesmo composto químico. Por exemplo, moléculas de água formam pontes de hidrogênio entre átomos de oxigênio e hidrogênio.
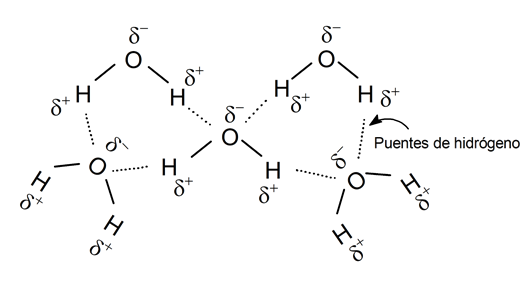
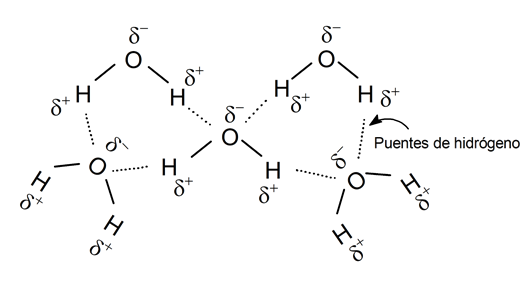
ligações duplas e triplas
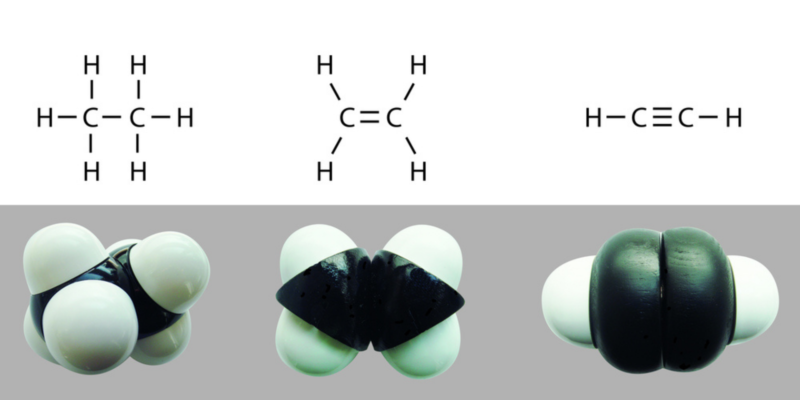

As ligações covalentes podem ser simples, duplas ou triplas. dependendo do número de pares de elétrons compartilhados entre os átomos que os compõem. Quanto mais elétrons forem compartilhados, mais forte será a ligação e mais energia será necessária para quebrá-la.
As ligações simples são representadas graficamente por uma única linha AA, as ligações duplas por dois A=A e as ligações triplas por três A≡A.
Exemplos de compostos com ligações covalentes
A ligação covalente é extremamente comum no mundo da química orgânica. Por exemplo, está presente em substâncias como:
- Bencino (C6H6)
- Metano (CH4)
- Glicose (C6H12O6)
- Amônia (NH3)
- Clorofluorocarburos (“Freón”) (CFC)
- Diamantes, grafites e outras formas de carbono (C)
Exemplos de compostos com ligações iônicas
Muitas substâncias possuem ligações iônicas em seus compostos, como:
- Óxido de magnésio (MgO)
- Sulfato de cobre(II) (CuSO4)
- Iodeto de potássio (KI)
- Cloreto de Manganês (MnCl2)
- carbonato de cálcio (CaCO3)
- Sulfeto de ferro (III) (Fe2S3)
Origem do conceito


Desde os tempos antigos, suspeitou-se que os elementos constituintes da matéria se agrupam segundo certas formas de afinidade. mas foi seria em 1704, quando Isaac Newton iria postular sua teoria da ligação químicacom base nas teorias atômicas já formuladas e observando que “uma força” mantinha os átomos unidos nas reações químicas observadas.
Em 1819, graças à invenção da bateria voltaica, Jöns Jakob Berzelius introduziu as noções de eletropositividade e eletronegatividade à teoria da combinação atômica e, mais tarde, no século XX, Gilbert Lewis introduziu o conceito de ligação formada por um par de elétrons, dando origem à possibilidade de ligações simples, duplas e triplas, já que os átomos poderiam compartilhar entre si e seis elétrons. Foi assim que surgiram as ligações covalentes.
Em 1927 também surgiu uma teoria semelhante à de Lewis., mas em que ocorreu uma transferência total de elétrons, e foi proposto por Walther Kossel. Isso daria origem a ligações iônicas.
Continue com: Forças intermoleculares