Explicamos o que é o átomo e como foi a história de sua descoberta. Além disso, quais são suas principais características.

O que é o átomo?
o átomo é a menor partícula em que a matéria pode ser dividida.
É importante esclarecer que a definição de átomo costuma usar o termo “partícula indivisível” para se referir à menor partícula que ainda retém as propriedades do elemento químico ao qual pertence, mas o átomo é formado por partículas ainda menores ( prótons, nêutrons, etc.). , elétrons), mas não possuem as propriedades do elemento químico.
As primeiras noções de átomo surgiram no início do século XIX.com o trabalho de Dalton, que formulou a primeira teoria atômica e descreveu pela primeira vez a existência de minúsculas partículas esféricas indivisíveis que compõem toda a matéria e que são iguais entre si em cada elemento químico.
Ao longo desse século e no início do século seguinte, o conceito foi sendo refinado por cientistas como Thomson e Rutherford, até chegar à formulação do modelo atômico de Böhr, proposto por Niels Böhr e segundo o qual os elétrons giram em torno do núcleo bem níveis de energia definidos.
Veja também: modelo atômico de Dalton
características do átomo

- É uma partícula muito pequena. O átomo é a menor partícula que mantém as propriedades do elemento químico ao qual pertence. É a menor unidade na qual a matéria pode ser dividida; De fato, em grego a palavra átomo significa “indivisível”, embora esse termo não seja totalmente correto, pois o átomo é formado por prótons, nêutrons e elétrons.
- É uma partícula infinitamente leve. A massa aproximada de prótons e nêutrons é 1,6726 x 10-27 kg y 1,6749 x 10-27 kg respectivamente; a dos elétrons é ainda menor: 9,1 x 10-31 Isso torna os átomos extremamente leves.
- Forma moléculas. Os átomos se agrupam para formar moléculas. Cada tipo de molécula é a combinação de um certo número de átomos ligados entre si de uma maneira específica, e uma molécula pode conter átomos de diferentes elementos químicos ou do mesmo elemento.
- é imutável. Cada átomo mantém suas características estruturais, além do fato de fazerem parte de moléculas diferentes. Durante as reações químicas, os átomos não são criados nem destruídos, mas dispostos de maneira diferente, criando ligações entre um átomo e outro.
- Tem um número fixo de prótons.. O que distingue os elementos químicos entre si (entre muitas outras características) é o número de prótons que seus átomos possuem no núcleo. O número de prótons é representado pela letra Z e é chamado de “número atômico”. O número de prótons corresponde ao número de elétrons em um átomo eletricamente neutro. O número atômico geralmente aparece na tabela periódica dos elementos, localizada acima do símbolo químico, à esquerda.
- Tende a instabilidade. A tendência normal da grande maioria dos átomos é se unir a outros átomos (do mesmo tipo ou de tipos diferentes) para formar agrupamentos estáveis (isto é, compostos químicos), pois isso leva a uma situação de energia mínima e estabilidade máxima. À medida que formam ligações químicas, eles ganham, perdem ou compartilham elétrons. Essas junções retêm energia que eventualmente é liberada como calor ou luz.
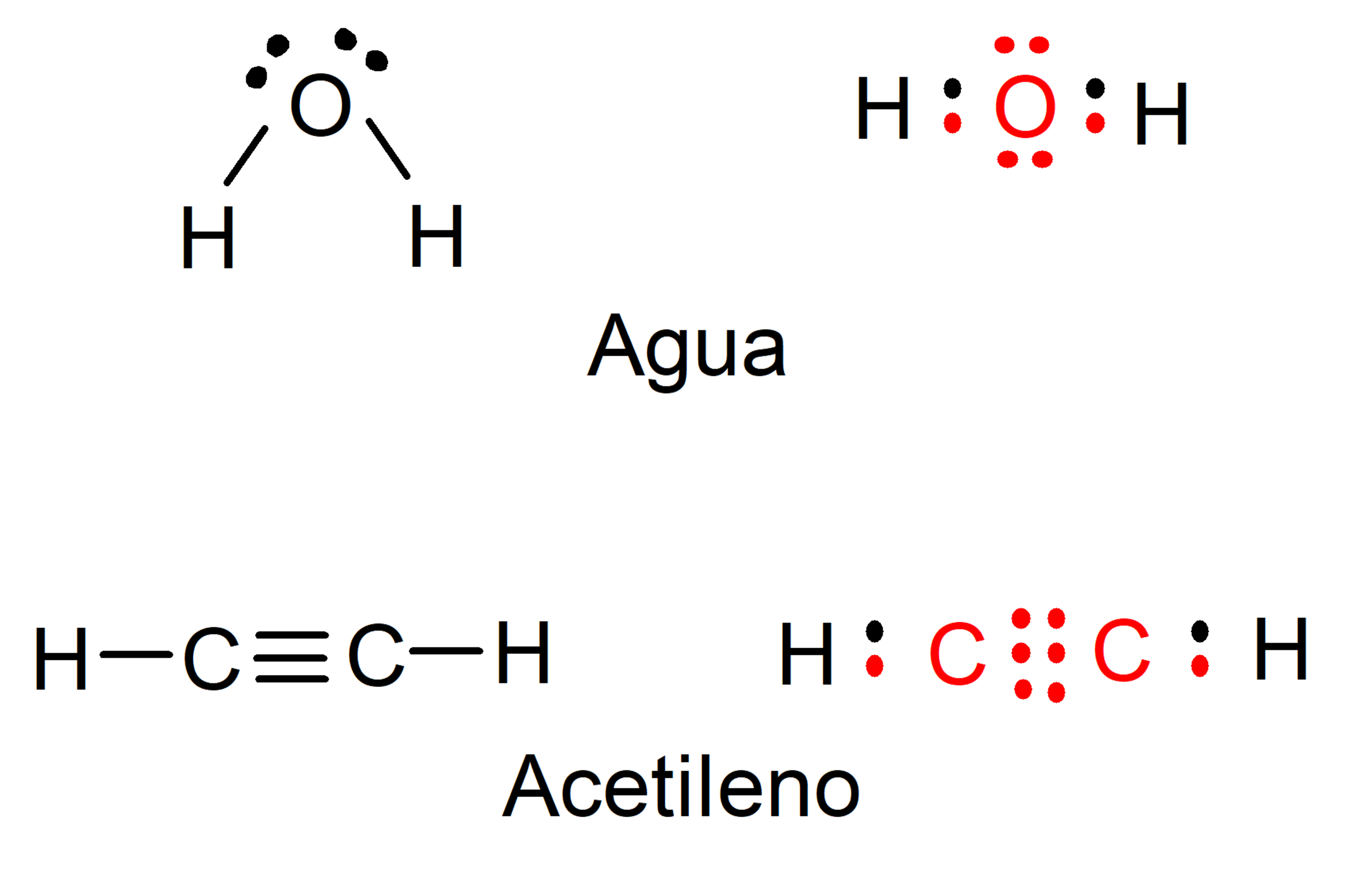
- Cumpra a regra do octeto. O que justifica a reatividade e a formação de ligações é que os átomos obedecem à regra do octeto de Lewis, o que indica que as ligações respondem à necessidade de adquirir a configuração eletrônica que caracteriza os gases nobres ou “inertes”, com oito elétrons localizados em sua última nível de energia. Por exemplo: a formação das moléculas de água e acetileno pode ser representada no diagrama a seguir, onde os elétrons do carbono e do oxigênio estão representados em vermelho, enquanto os do hidrogênio estão representados em preto.
estrutura do átomo

o átomo é composto de um núcleo central e uma nuvem de elétrons ao redor desse núcleo. O núcleo contém partículas carregadas positivamente chamadas prótons e também partículas não carregadas conhecidas como nêutrons. A nuvem de elétrons carregada negativamente é atraída pelos prótons no núcleo por uma força eletromagnética. Por sua vez, os elétrons são caracterizados por orbitais atômicos, que são funções matemáticas que representam a probabilidade de encontrar um elétron em uma região do espaço ao redor do núcleo.
Pode lhe interessar: Átomo de carbono
massa do átomo
a massa de um átomo É dado principalmente pela soma dos prótons e nêutrons em seu núcleo. (uma vez que a massa dos elétrons é infinitamente pequena e, portanto, desprezível). Este parâmetro é chamado de número de massa e é representado pela letra A.
No entanto o número de prótons é idêntico para todos os átomos de um determinado elemento químico, o número de nêutrons pode variar em alguns desses elementos. Isso acontece, por exemplo, com o carbono ou o nitrogênio, que são elementos que possuem vários isótopos, como o chamado carbono -14 ou nitrogênio -15.
Os números de massa (soma de prótons e nêutrons) desses dois isótopos são 14 e 15, respectivamente.. Ou seja, o carbono -14 tem 6 prótons e 8 nêutrons, enquanto o nitrogênio -15 tem 7 prótons e 8 nêutrons.
reatividade química

Embora prótons e nêutrons sejam importantes em termos de massa e reações nucleares, são os elétrons (especialmente aqueles no último nível de energia da nuvem de elétrons) os responsáveis pela reatividade química dos átomos.
São os elétrons que, em última análise, vão permitir que infinitos compostos químicos sejam produzidos e decompostos o tempo todo. Quer dizer, os elétrons são as partículas subatômicas que formam as ligações químicas entre os átomos para formar vários compostos químicos.
Pode te ajudar: Forças intermoleculares