Explicamos o que são os estados de agregação e como são classificados. Além disso, quais são suas características e as alterações que apresentam.


O que são estados de agregação?
Eles são chamados de estados de agregação da matéria (ou simplesmente estados da matéria) uma as fases ou momentos que apresentam as diferentes substâncias conhecidas, de acordo com as forças de união existentes entre as partículas que as compõem. Tradicionalmente são conhecidas quatro fases da matéria: líquida, sólida, gasosa e plasmática.
Cada uma dessas fases ou momentos, chamados de “estados”, tem suas próprias características físicasdiferentes daquelas apresentadas pela mesma substância em outros estados diferentes, apesar de sua constituição química (a composição atômica das partículas que a compõem) não mudar em nada.
Entende-se, então, que todos matéria está em algum tipo de fase em um determinado momentomas pode ser levado a outro variando a temperatura e/ou pressão a que está submetido, dando origem a uma série de processos físicos denominados “métodos de mudança de fase”: solidificação, fusão, sublimação, deposição, condensação, vaporização, ionização e deionização.
Veja também: Metaloides
Tipos de estados da matéria


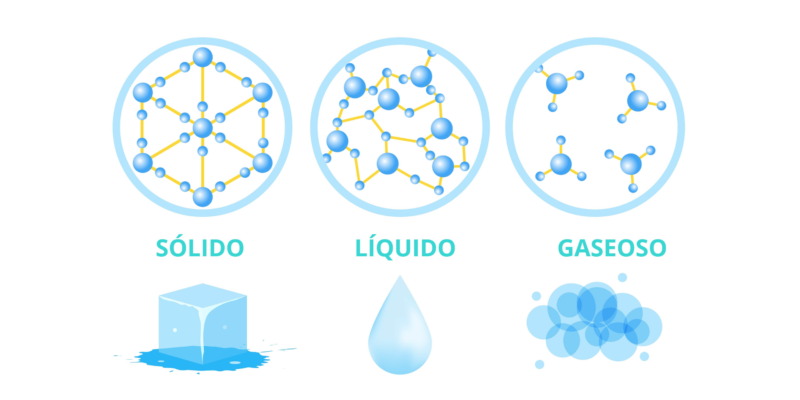
Se conhecem quatro tipos de estados da matéria: sólido, líquido, gasoso e plasmacada um diferente em variáveis como dureza, resistência, maleabilidade, fluidez, volume e coesão, bem como na relação entre suas determinadas partículas.
No entanto, é possível levar a matéria a estados de agregação que normalmente não ocorrem na natureza, mas em condições laboratoriais muito específicas e controladas: condensado de Bose-Einstein, condensado de Fermi, plasma supersólido ou quark-gluon, este último ainda de natureza hipotética.
Estado sólido


O estado sólido é reconhecível porque a matéria apresenta um corpo definido, com volume adequado e forma constante, dependendo da substância em questão. Seus átomos se encontram formando estruturas estreitas e rígidas, que oferecem resistência a forças externas.
Em termos gerais, são resistentes à fragmentaçãopossuem pouca ou nenhuma fluidez, alta coesão e uma memória de forma que lhes confere elasticidade, ou seja, a capacidade de recuperar sua forma se forem retirados de sua configuração original.
Exemplos de matéria em estado sólido são gelo, pedra, cerâmica, madeira, osso.
Segue: Estado Sólido
Estado líquido


matéria em estado líquido apresenta uma ligação muito mais fraca entre seus átomos do que no caso dos sólidos, o que lhe confere a fluidez, sua principal característica.
Isso significa que a matéria não tem uma certa forma, mas assume a do recipiente em que está contida.
Em termos gerais, matéria líquida tem menos coesãomovimento de energia cinética, fluidez, difusão, baixa compressibilidade e contração na presença de frio (exceto água).
Exemplos de matéria em estado líquido são água, mercúrio, sangue, leite.
Estado gasoso


A matéria no estado gasoso é chamada de gás. consiste principalmente de partículas fracamente ligadasexpandidos e com uma força de atração muito pequena, o que os impede de ter forma e volume definidos.
A liberação de um gás, de fato, faz com que ele se expanda livremente até encher o recipiente onde está contido.
os gases tem uma densidade muito baixapois suas partículas apresentam uma relativa desordem: movem-se muito rapidamente.
Também apresentam baixa resposta à ação da gravidade, coesão quase zero e volume variávelmas uma capacidade de compressão muito alta.
Exemplos de gases são ozônio, gás natural para cozinhar, hélioe os gases que compõem a atmosfera.
Mais em: Estado gasoso
estado plasmático


Quando falamos de plasma ou substância em estado plasmático, falamos de um gás ionizadoou seja, cujos átomos perderam sua eletroneutralidade e formam ânions (-) ou cátions (+).
Isso significa que o estado plasmático é semelhante ao gasoso, mas com propriedades bem diferentes das do “gás frio”como sua tendência a conduzir eletricidade ou sua grande resposta a campos magnéticos.
Existem dois tipos de plasma:
- plasma frio. Não causa queimaduras porque suas partículas não se movem tão rápido quanto seus elétrons.
- plasma quente. Em que os átomos estão colidindo uns com os outros enquanto se movem (e perdem elétrons) e geram luz e calor no processo.
Um exemplo de matéria plasmática é o fogo, ou mesmo o solou o conteúdo de lâmpadas de plasma.
Mudanças de estado sólido


O estado sólido de agregação pode se tornar um líquido ou um gás, através de processos conhecidos como:
- Fusão. Passagem do sólido para o líquido. Geralmente requer um aumento de temperatura, o que induz as partículas de repouso próximo a se moverem e expandirem a distância entre elas, relaxando a ligação e, portanto, também a estrutura da junta. Um exemplo desse processo é o aquecimento de metais em siderúrgicas para moldá-los e permitir que retornem à solidez (no resfriamento).
- Sublimação. Passagem do sólido ao gás (sem passar pelo líquido). Isso geralmente requer condições de pressão específicas, como neve ou gelo no topo das montanhas, onde nunca atingirá a temperatura de fusão, mas vai diretamente para o vapor. Podemos ver esse efeito no gelo seco (CO2 congeladas).
Mudanças no estado líquido
O estado líquido de agregação pode se tornar um sólido ou um gás através de processos conhecidos como:
- Solidificação. Mudança de líquido para sólido quando a pressão é aplicada ao líquido. Como consequência, ocorre a perda de energia cinética (calor), o que faz com que as partículas comecem a se mover bem mais lentamente até comporem uma estrutura fixa (geométrica no caso da cristalização) e constante. Um exemplo disso é a solidificação da água.
- Congelando. Mudança de líquido para sólido quando uma diminuição na temperatura abaixo do ponto de congelamento do líquido é aplicada.
- Vaporização. Mudança de líquido para gasoso, geralmente devido ao aumento da temperatura do líquido, que leva à separação de suas ligações já frouxas entre as partículas e, portanto, à perda de sua coesão. Isso é o que acontece quando fervemos a água.
mudanças no estado do gás


O estado gasoso pode mudar para sólido, líquido ou plasmático, de acordo com os seguintes processos:
- condensação e liquefação. Estes dois processos implicam a passagem de um estado gasoso para um estado líquido. A condensação ocorre a partir da perda de energia cinética (resfriamento), como ocorre nas nuvens altas na atmosfera, durante o ciclo da água. A liquefação é causada por um aumento na pressão que força as partículas a se unirem e se relacionarem novamente.
- Deposición o sublimación inversa. Esse é o nome dado à passagem do estado gasoso para o sólido, que também pode ser chamada de cristalização. Ocorre, por exemplo, no ar congelado, cujo vapor de água passa diretamente para os cristais de gelo.
- ionizacao. Ocorre pela perda de elétrons dos átomos de um gás, devido ao aumento da movimentação de suas partículas, o que leva ao estado de agregação plasmática.
Mudanças no estado do plasma
A matéria no estado plasmático pode retornar ao estado gasoso através de um processo chamado de deionização, no qual o calor é removido e suas partículas recuperam os elétrons perdidosvoltando a ser um gás.
Outros estados de agregação
Numerosos estados de agregação diferentes estão sendo experimentados, dando origem a substâncias específicas, como ferrofluidosaerógrafos e toda uma gama de novos materiais.