Explicamos o que são os estados sólido, líquido e gasoso e as propriedades que possuem. Além disso, suas características e exemplos.
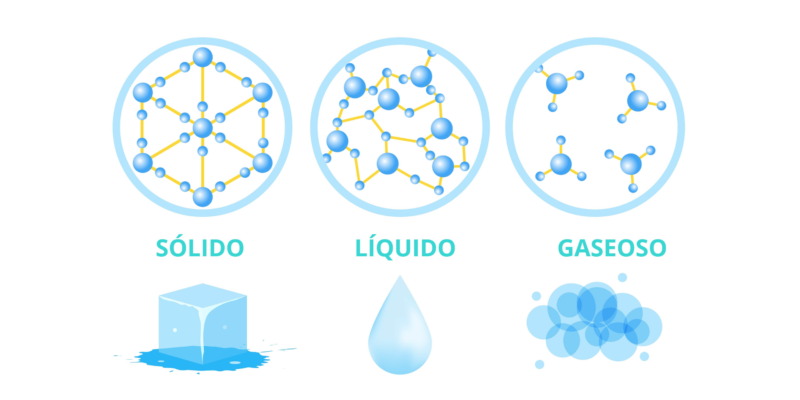

Quais são os estados sólido, líquido e gasoso?
Quando falamos de estados de agregação da matéria, trata-se de as maneiras pelas quais o assunto pode ser apresentado, dependendo da relação entre as partículas que o compõem. Três são geralmente conhecidos, também referidos como fases: o estado sólido, líquido e gasoso.
O estado de agregação determina as várias propriedades físicas da matéria. Embora as substâncias sejam quimicamente idênticas, as diferenças físicas são drásticas. Isso pode ser visto, por exemplo, na água, que pode ser líquida, sólida (gelo) ou gasosa. Embora em todos os casos a composição química da água permaneça a mesma (H2O), físicamente se comporta distinto en cada estado.
Além disso existem outros estados menos frequentes de agregação. Entre eles estão o estado plasmático ou supersólido, mas essas formas não ocorrem espontaneamente na natureza, mas sim em laboratórios.
Veja também: Misturas
Estado sólido


matéria em estado sólido apresenta suas partículas muito unidas por fortes forças atrativas. As partículas estão muito próximas umas das outras e vibram lentamente.
eles se comportam como um corpo único, com grande coesãomaior densidade do que outros estados e uma forma constante.
corpos sólidos são resistente à fragmentação e são dotados de memória de forma, ou seja, tendem a permanecer sempre iguais a si mesmos.
os sólidos ter pouca ou nenhuma fluência, porque eles mantêm sua forma acima de tudo. Em geral, eles não podem ser comprimidos, pois suas partículas estão o mais próximas possível. Quando um sólido é quebrado ou fragmentado, novos objetos sólidos menores são obtidos.
Segue: Estado Sólido
Tipos de sólidos e exemplos


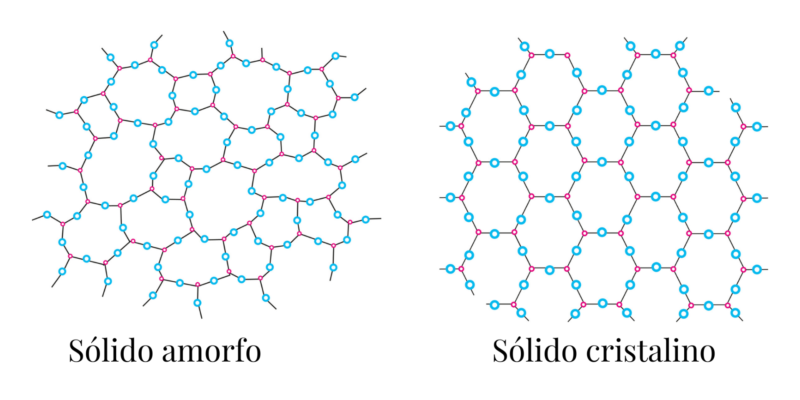
Existem dois tipos de sólidos, de acordo com a forma como suas partículas são ordenadas:
- Cristalinos. Eles são formados por células dispostas geometricamente, por isso costumam ter uma forma regular e precisa, com base em um padrão. Por exemplo: metais, compostos iônicos como cloreto de sódio (NaCl) e diamante.
- Amorfo ou vítreo. Como suas partículas não se agrupam em uma estrutura ordenada ou em um determinado padrão, sua forma costuma ser irregular e variada, dependendo das condições em que foram produzidas. Por exemplo: vidro e borracha.

o estado líquido


No caso dos líquidos, suas partículas ainda estão unidas por forças atrativas, mas são muito mais fracas e desordenadas que as dos sólidos. Por esta razão, os líquidos não podem conservar uma forma fixa ou estável, nem têm tanta coesão e resistência como os sólidos.
Os líquidos adquirem a forma do recipiente que os contém, embora suas partículas não necessariamente se dispersem até ocuparem todo o seu volume, como ocorre em um gás. Por outro lado, possuem grande fluidez, de fato, podem ser inseridos e extraídos através de pequenos espaços. Sua tensão superficial os faz aderir aos objetos, e é por isso que a água fica molhada.
os líquidos são incompressíveis e têm seu próprio volume. Além disso, com exceção da água, eles tendem a encolher quando resfriados.
Tipos de líquidos e exemplos


Os líquidos são fluidos, portanto podem ser classificados de acordo com sua fidelidade aos princípios físicos descritos por Isaac Newton em seus estudos sobre a viscosidade. Pode ser:
- Fluidos newtonianos. Cumprem com as prescrições de Newton, mantendo a sua viscosidade constante. Esses são os fluidos mais fáceis de descrever, quanto mais densos, mais lentos eles fluem. Por exemplo: água, querosene, gasolina e álcool.
- Fluidos no newtonianos. Trata-se de um tipo especial de fluido que não obedece às equações de Newton, pois sua viscosidade ou oposição ao escoamento varia com a variação da temperatura, por isso possuem apenas uma viscosidade aparente. Esses fluidos são quase sempre obtidos artificialmente. Por exemplo: breu, lava, sangue e iogurte.
o estado gasoso


As partículas de gás estão em um estado caótico de dispersão e de tal distância, que eles são mantidos juntos com dificuldade. A força de atração entre eles é muito fraca, então os gases ocupam um volume muito maior que os líquidos e sólidos.
substâncias no estado gasoso tendem a se expandir para ocupar todo o espaço que os contém. Os gases também carecem de uma forma fixa e também de um volume fixo e respondem muito pouco à gravidade.
Mais em: Estado gasoso
Tipos de gases e exemplos


Os gases são normalmente classificados de acordo com as suas propriedades químicas, que podem ser muito diversas, por exemplo:
- gases inertes. São gases com pouquíssima reatividade química, como os gases nobres.
- gases inflamáveis. São gases facilmente combustíveis na presença de oxigênio e calor, razão pela qual produzem reações explosivas e exotérmicas.
- gases corrosivos. São gases que possuem uma capacidade inata de gerar corrosão, ou seja, cujo pH é tão ácido ou tão básico que causam danos às superfícies por contato.
Alguns exemplos simples de gases são: ar, metano (CH4), dióxido de carbono (CO2), ozônio (O3) e hélio (He).
Mudanças de fase para sólido
As mudanças de fase são os processos físicos que convertem a matéria de um estado para outro, geralmente sem alterar suas propriedades químicas. Os seguintes são aqueles que convertem a matéria de líquido ou gás para sólido:
- Solidificação. É o processo pelo qual o aumento da pressão de um líquido o transforma em um sólido. Durante esse processo, as partículas do líquido se aproximam, o que faz com que sejam estabelecidas interações entre elas que geram estruturas mais fortes típicas de um sólido.
- Congelando. Consiste na transformação de um líquido em um sólido pelo resfriamento do líquido. Isso é o que acontece quando você congela a água.
- deposição. É o processo que consiste em retirar energia térmica de um gás, o que pode fazer com que suas partículas se agrupem e percam sua enorme velocidade, tornando-se cristais sólidos sem antes passar pelo estado líquido. Também é conhecida como sublimação reversa e geralmente ocorre no topo das montanhas, sempre cobertas de gelo.
Mudanças de fase para líquido


Os processos de mudança de fase que levam à mudança de sólido ou gás para líquido são:
- Fusão. É o processo pelo qual a temperatura de um sólido é aumentada até que se torne um líquido. A energia térmica é fornecida à matéria sólida até que sua temperatura atinja seu ponto de fusão, fazendo com que suas partículas ganhem movimento e velocidade, até derreter, fluir e se tornar líquida. É o que se faz na metalurgia com o ferro, que é aquecido até derreter.
- Liquefação. Ocorre quando um gás é submetido a pressões muito altas, forçando-o a se tornar um líquido, sem alterar sua temperatura. É assim que se obtêm gases liquefeitos, como o butano líquido e o metano.
- Condensação. Novamente, a remoção de calor (resfriamento) de um gás faz com que suas partículas se movam mais lentamente. Dessa forma, estabelecem-se interações entre suas partículas e formam-se gotas líquidas em qualquer superfície. É o que acontece com o vapor de água no espelho quando tomamos banho.
Mudanças de fase para gás
Finalmente, as mudanças de fase que levam ao estado gasoso são:
- Ebulição. É produzido pela introdução de energia térmica em um líquido, de modo que sua temperatura sobe além de seu ponto de ebulição: suas partículas começam a vibrar muito mais rápido e o espaço entre elas é ampliado, e a matéria líquida é transformada em gás. Podemos verificar isso ao ferver água na cozinha.
- Evaporação. É o processo pelo qual um líquido se transforma em gás quando a temperatura do líquido aumenta e ocorre lentamente. Não é necessário que a temperatura do líquido atinja o ponto de ebulição para que ele comece a se transformar em gás.
- Sublimação. Sob certas condições de pressão e temperatura, é possível mobilizar rapidamente as partículas de um sólido, de modo que ele se transforme diretamente em gás, sem antes passar pelo estado líquido. Isso ocorre com gelo seco (gelo de CO2) em temperatura ambiente.
O estado do plasma


É conhecido como plasma um quarto estado de agregação da matéria, que consiste em um gás ionizado. Os átomos desses gases tiveram seus elétrons removidos e, portanto, têm uma carga elétrica fixa (ânions – e cátions +). Por esta razão, o plasma é um excelente transmissor de eletricidade.
Existem dois tipos de plasma:
- plasma frio. Os elétrons estão a uma temperatura mais alta que os íons.
- plasma quente. Seus átomos ionizados ficam extremamente quentes, por isso gera luz e calor.
Alguns exemplos de plasma são o Sol, telas eletrônicas ou o interior de lâmpadas fluorescentes (como neon).
Ele pode te ajudar: Separação de misturas








