Explicamos o que são gases, como são classificados e as propriedades que apresentam. Além disso, quais são suas características e exemplos.


O que são gases?
Pelo termo gás entendemos um dos três principais estados de agregação da matéria (juntamente com líquidos e sólidos). Caracteriza-se pela dispersão, fluidez e pouca atração entre suas partículas constituintes.
gases são a forma mais volátil de matéria na natureza E são extremamente comuns no dia a dia. Assim, quando uma substância está no estado gasoso, costumamos chamá-la de gás.
Substâncias líquidas ou sólidas podem ser transformadas em gás usando diferentes processos. Essa transformação implica uma mudança nas propriedades físicas das substâncias, como seu estado de agregação. No entanto, suas propriedades químicas não mudam, pois as substâncias continuam com a mesma estrutura química, ou seja, as ligações químicas não se quebram ou novas substâncias são geradas.
os gases eles estão em toda parte: desde a massa heterogênea de gases que chamamos de atmosfera e que respiramos como ar, aos gases que são gerados no intestino, produto da digestão e decomposição, aos gases inflamáveis com os quais alimentamos nossas cozinhas e fornos.
Veja também: Estados de agregação
história dos gases
Palavra gás Foi inventado no século XVII pelo cientista flamengo Jan Baptista van Helmontdo termo latino caos (“caos”).
Ele escolheu o nome por causa do aparente grau de desordem que as moléculas de gás exibem. Além disso Este estado era conhecido como o “estado aeriforme”mas esse termo caiu em desuso.
As primeiras leis sobre o comportamento dos gases foram resultado de seu intenso estudo no final do mesmo século, especialmente suas relações entre pressão, temperatura e volume.
Isto conduziu a Émile Clapeyron para formular a lei ideal para todos os gases (“Lei dos Gases Ideais”) em 1834.
gás ideal e gás real
Um gás ideal é um modelo de um gás criado por seres humanos., e que não possui interações entre as partículas que o formam, ou seja, não possuem atração ou repulsão entre si. Por outro lado, um gás real exibe essas interações.
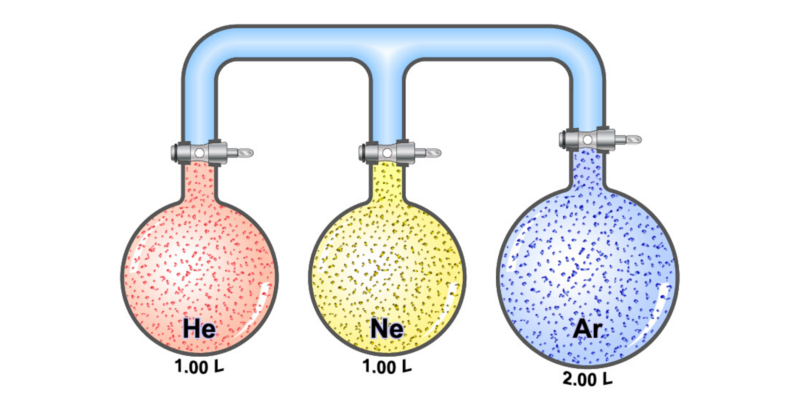
Quanto mais simples a fórmula química de um gás real e menor sua reatividade, mais ele pode se assemelhar a um gás ideal. Assim, os gases monoatômicos, por exemplo, o hélio (He), são os que mais se comportam de maneira semelhante aos gases ideais.
Mais em: Gases ideais
leis do gás

Uma das leis mais utilizadas para descrever o comportamento dos gases é a Lei dos Gás Ideal, que, por sua vez, pode ser entendida como a combinação de outras leis:
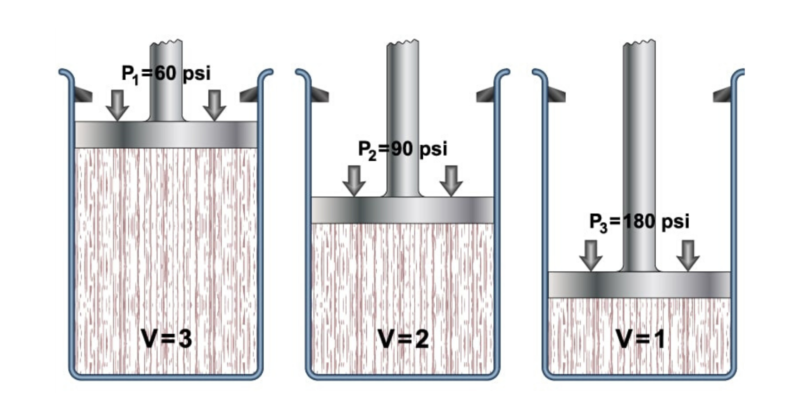
- Lei de Boyle-Mariotte. Determina que o volume de um gás varia inversamente proporcional à pressão absoluta do recipiente onde está contido, se a temperatura permanecer constante. É expresso de acordo com a equação:
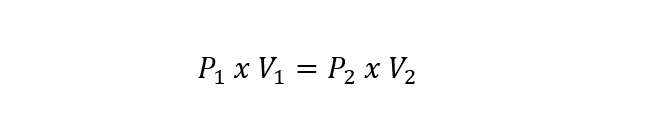
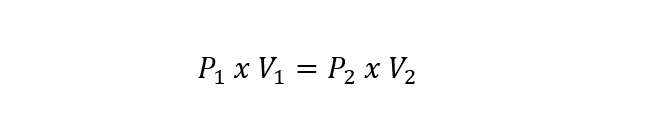
- Lei de Gay-Lussac. Explique que a pressão de uma massa de gás cujo volume permanece constante é diretamente proporcional à sua temperatura (expressa em graus kelvin). Isso é representado da seguinte forma:
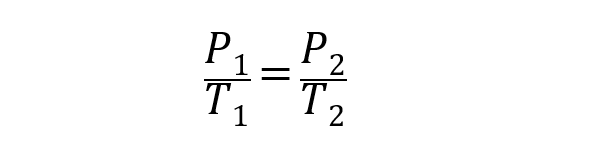
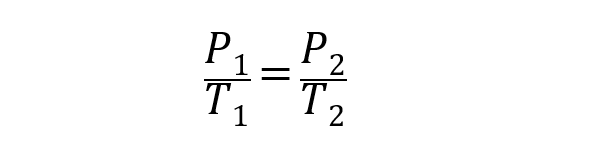
- lei de charles. Expressa que a temperatura e o volume de um gás são diretamente proporcionais quando a pressão é constante. Essa lei é representada pela seguinte equação:
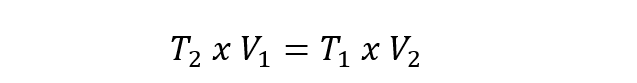
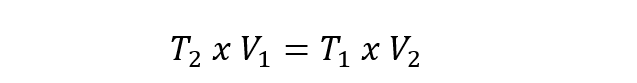
Em todos os casos acima V1, P1 y T1 são o volume inicial, a pressão e a temperatura. Enquanto que V2, P2 y T2 são o volume final, a pressão e a temperatura.
- Lei de Avogadro. Expressa que sob condições iguais de pressão e temperatura, volumes de diferentes compostos gasosos contêm o mesmo número de partículas.
- Lei dos gases ideais. Da combinação das leis anteriores, obtém-se a Lei do Gás Ideal, cuja equação é representada da seguinte forma:
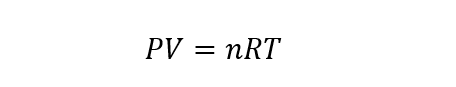
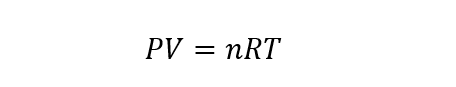
Onde P, V y T Eles são pressão, volume e temperatura. Enquanto que n é o número de moles do gás e R é a constante do gás ideal cujo valor é 8,31451 J/molK.
tipos de gases
Os gases podem ser classificados de acordo com sua natureza química em:
- Combustibles o inflamables. Aqueles que podem queimar, ou seja, gerar reações explosivas ou exotérmicas na presença de oxigênio ou outros oxidantes.
- Corrosivos. Aqueles que, ao entrarem em contato com outras substâncias, as submetem a intensos processos de redução ou oxidação, causando danos à sua superfície ou feridas no caso da matéria orgânica.
- queimando. Aqueles que permitem manter viva uma chama ou uma reação inflamável, pois induzem a combustão de outras substâncias.
- Tóxicos. Aqueles que representam um perigo para a saúde devido às reações que introduzem no corpo dos seres vivos, como os gases radioativos.
- inerte ou nobre. Aqueles que apresentam pouca ou nenhuma reatividade, exceto em determinadas situações e condições.
Propriedades do gás


Os gases têm as seguintes propriedades:
- Eles não têm seu próprio volume.. Eles ocupam o volume do recipiente em que estão localizados.
- Eles não têm sua própria forma. Eles também assumem o de seu contêiner.
- Eles podem expandir e contrair. Como sólidos e líquidos, os gases se expandem quando sua temperatura aumenta e se contraem quando são resfriados.
- Eles têm muita fluência. Os gases fluem muito mais que os líquidos porque suas partículas têm menos interação. Eles podem se mover facilmente através de um orifício de um recipiente para outro.
- Eles têm alta difusão. Os gases podem se misturar facilmente entre si devido ao grande movimento de suas partículas.
- Solubilidade. Os gases podem ser solúveis em água ou outros líquidos.
- pode ser comprimido. Ao aplicar pressão a um gás, suas partículas podem ser aproximadas, ou seja, o gás é comprimido.
mudança de estado dos gases


- Sublimação. É um processo físico de mudança de fase, que permite que um sólido seja convertido diretamente em um gás, sem passar primeiro por um estágio líquido. Este processo é incomum e geralmente envolve condições específicas de pressão e temperatura. Podemos observá-lo em gelo seco (ou gelo) à temperatura ambiente: o bloco sólido emite um leve vapor que é a substância recuperando seu estado gasoso original.
- Ebulição. É o processo pelo qual um líquido é transformado em um gás. Ocorre quando toda a massa do líquido é aquecida a uma temperatura igual ao seu ponto de ebulição.
- Evaporação. É um processo de mudança de fase extremamente comum, que leva um líquido a se transformar em gás quando a temperatura do líquido é aumentada. Acontece lenta e gradualmente. Colocamos em prática, por exemplo, no chuveiro quando a água muito quente se transforma em vapor que pode ser visto como uma nuvem esbranquiçada.
- Condensação. É o processo oposto à evaporação, ou seja, um processo de mudança de fase que leva do estado gasoso ao estado líquido, devido à perda de energia térmica. Essa energia perdida faz com que as partículas de gás vibrem mais lentamente, permitindo que elas se aproximem e interajam mais intimamente, como acontece em um vidro frio em um dia de chuva, ou em plantas e outras superfícies com orvalho.


- sublimação reversa. É o caminho inverso da sublimação, ou seja, a passagem do estado gasoso para o estado sólido sem antes passar por um momento de liquidez. Este processo requer condições muito específicas de pressão e temperatura.
Plasma


O estado plasmático da matéria é considerado um quarto estado de agregação, mas apresenta enormes semelhanças com o estado gasoso, pois é basicamente um gás ionizado, ou seja, um gás cujas partículas perderam elétrons e adquiriram certa carga eletromagnética. Existem plasmas frios, como o usado nas lâmpadas de “lava”, ou plasmas quentes, como o fogo que envolve o Sol.
Exemplos de Gás


Alguns exemplos de gases são:
- Hidrogênio (H)2). É o gás diatômico mais comum em todo o universo.
- Hélio (Ele). Insípido, incolor e inerte, é o menos solúvel em água de todos os gases.
- Metano (CH4). É um hidrocarboneto gasoso de odor desagradável que se obtém como produto da decomposição da matéria orgânica.
- ar. É a mistura heterogênea de hidrogênio, nitrogênio, oxigênio, argônio e outros gases que os seres vivos respiram.
Continuar com: Fluidos