Explicamos o que são gases ideais, sua classificação e as propriedades que apresentam. Além disso, suas características gerais e para que servem.

O que são gases ideais?
é chamado de gás ideal um gás hipotético ou teórico, que seria composto de partículas que se movem aleatoriamente e sem interagir umas com as outras.
Sua energia cinética é diretamente proporcional à temperatura.. As colisões entre as moléculas que o compõem (entre si e com o recipiente) são elásticas, ou seja, conservam o momento e a energia cinética.
Se trata de um conceito útil que pode ser analisado fazendo uso da mecânica estatísticaatravés de uma equação de estado simplificada conhecida como “lei dos gases ideais”.
Muitos dos gases reais conhecidos na química se comportam à temperatura e pressão ambiente como um gás ideal, pelo menos do ponto de vista qualitativo. Isso permite que sejam estudados como gases ideais dentro de certos parâmetros razoáveis.
No entanto, o modelo de gás ideal Tende a falhar quando a temperatura é baixa e a pressão é alta, pois nessas condições a interação das partículas gasosas é considerável e os espaços intermoleculares não podem ser considerados como vácuo.
No entanto, este modelo não é adequado para gases pesados, como gases refrigerantes, mas funciona bem para gases leves, como hidrogênio molecular (H2) e para alguns gases pesados como o dióxido de carbono (CO2).
Veja também: Fluidos
tipos de gases ideais
Existem três tipos básicos de gases ideais, de acordo com o tipo de abordagem física escolhida para sua abordagem:
- Gás ideal de Maxwell-Boltzmann. Por sua vez, pode ser: gás ideal termodinâmico clássico ou gás ideal quântico, dependendo da abordagem física aplicada em seu estudo.
- Gás ideal quântico de Bose. É formado por bósons, que são um tipo de partícula elementar. Por exemplo: os fótons, que são partículas que carregam radiação eletromagnética como a luz visível, são um tipo de bóson.
- gás ideal quântico de Fermi. É composto de férmions, que são outro tipo de partículas elementares. Por exemplo: os elétrons, que são uma das partículas que compõem os átomos, são um tipo de férmion.
Propriedades dos Gases Ideais
Algumas das principais propriedades dos gases ideais são:
- Têm sempre o mesmo número de moléculas.
- Eles não têm forças atrativas ou repulsivas entre suas moléculas.
- Eles não podem passar por transições de fase (gás-líquido, gás-sólido).
- As moléculas de um gás ideal ocupam sempre o mesmo volume nas mesmas condições de pressão e temperatura.
lei dos gases ideais


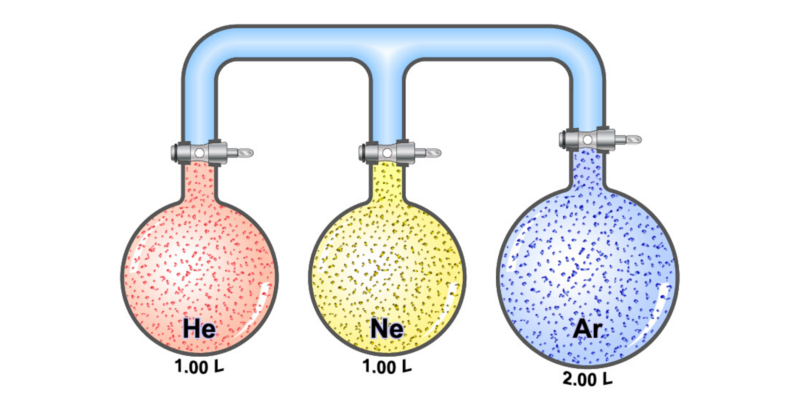
O estado de uma quantidade de matéria gasosa é descrito com base em quatro variáveis diferentes: pressão, volume, temperatura e número de moles de gás.
A relação matemática ideal entre esses fatores é justamente a lei dos gases ideais, que prevê o comportamento da maioria dos gases reais à temperatura e pressão ambiente.
Esta lei permite que uma das quatro variáveis seja calculada com base no conhecimento das outras três, de acordo com a equação que a expressa:
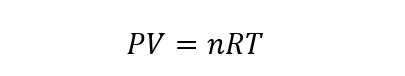
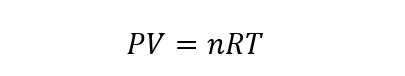
P representa a pressão do gás, V seu volume, n o número de moles de gás (que deve permanecer constante), R a constante do gás ideal (igual a 8,314472 J/molK) e T a temperatura do gás em questão.
Se um gás obedece a esta lei, pode ser tratado como se fosse ideal..
Esta lei é também a combinação das leis de Boyle, Gay-Lussac, Charles e Avogadro.
Lei de Boyle
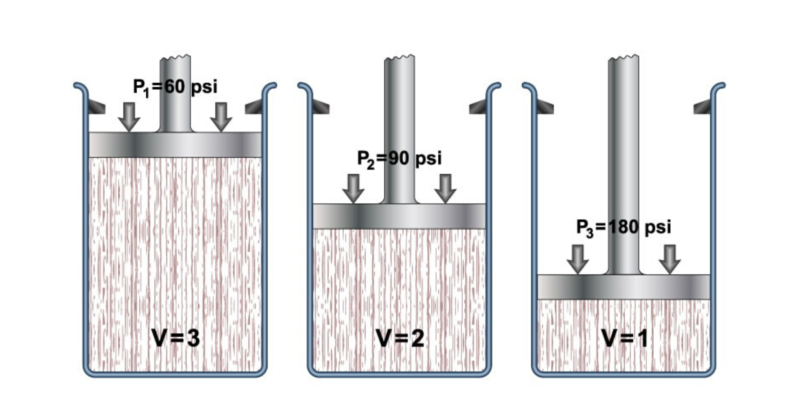

No século XVII, o cientista Robert Boyle realizou uma série de experimentos usando gases e líquidosgraças ao qual determinou o efeito da pressão sobre o volume dos gases.
Isso o levou a formular sua lei, que afirma que “o volume de um gás varia inversamente à pressão se a temperatura permanecer constante”.
Isso é representado para gases ideais pela seguinte equação:
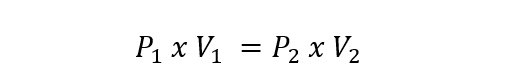
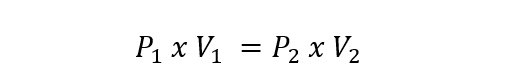
Onde P1 y V1 são a pressão inicial e o volume do gás, enquanto P2 y v2 são a pressão e o volume finais.
Lei de Gay-Lussac
Esta lei explica que a pressão de uma massa de gás cujo volume permanece constante é diretamente proporcional à sua temperatura (expressa em kelvin). Estava criado por Joseph Louis Gay-Lussac em 1802.
Para gases ideais, esta lei é representada pela equação:
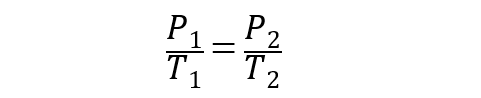
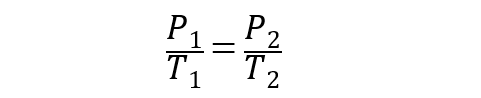
Onde P1 y T1 são a pressão inicial e a temperatura do gás, enquanto P2 y T2 são a pressão e a temperatura finais.
lei de charles
Graças aos estudos do francês Jacques Charles em 1787, temos esta lei que expressa a relação diretamente proporcional entre a temperatura e o volume de um gása uma certa pressão.
A equação que representa esta lei é a seguinte:
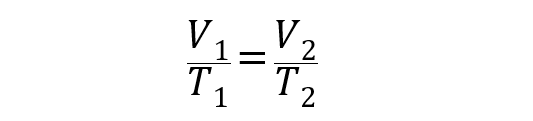
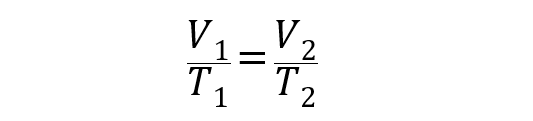
Onde V1 y T1 são o volume e a temperatura inicial do gás, enquanto V2 y T2 são o volume e a temperatura final.
Lei de Avogadro

é uma lei formulado em 1811 por Amadeo Avogadroque descobriu que:
“Volumes iguais de diferentes substâncias gasosas, medidos nas mesmas condições de pressão e temperatura, contêm o mesmo número de moléculas.”
Para que serve o modelo de gás ideal?
A noção de gás ideal vem de a necessidade de entender o funcionamento desses fluidosamplamente utilizado na indústria.
Em vez de criar um modelo para cada tipo de gás, sua formulação ideal é utilizadaou seja, um modelo simplificado a partir do qual a maioria dos gases pode ser estudada.
gases ideais e não ideais


Gases não ideais são gases reais.ou seja, aqueles que existem na vida real e cujo comportamento nem sempre está de acordo com o previsto pela lei dos gases ideais.
Esse fica mais evidente no caso de gases pesados, como o vapor de água, cujas interações entre as moléculas são muito consideráveis, de modo que seu comportamento não pode ser aproximado ao de um gás ideal. Por outro lado, outros gases leves (como o hidrogênio) tendem a se aproximar de um gás ideal em condições normais de pressão e temperatura.
Continuar com: gases nobres








