Explicamos o que é uma ligação covalente, sua polaridade e como é classificada. Além disso, quais são suas características e alguns exemplos.

O que é uma ligação covalente?
Uma ligação covalente é um tipo de ligação química em que dois átomos se ligam compartilhando elétrons em sua camada atômica mais externa ou em seu último orbital atômico (probabilidade de encontrar um elétron ao redor do núcleo), e assim atingir o octeto estável (de acordo com a “regra do octeto” de Gilbert Newton Lewis). Átomos ligados compartilham um (ou mais) pares de elétrons.
Este tipo de ligação difere da ligação iônica porque os átomos que a formam têm uma diferença de eletronegatividade menor que 1,7, enquanto na ligação iônica eles têm uma diferença maior que 1,7.
ligações covalentes se forman entre átomos de iguales o distintos elementos no metálicos e entre um ametal e hidrogênio.
As ligações covalentes são diferentes das ligações iônicas, pois na formação das ligações iônicas há uma transferência de elétrons de um átomo para outro, formando íons de cargas opostas que são então atraídos eletrostaticamente. Além disso, a ligação iônica é formada entre átomos de um metal e um ametal.
Veja também: Forças intermoleculares
regra do octeto
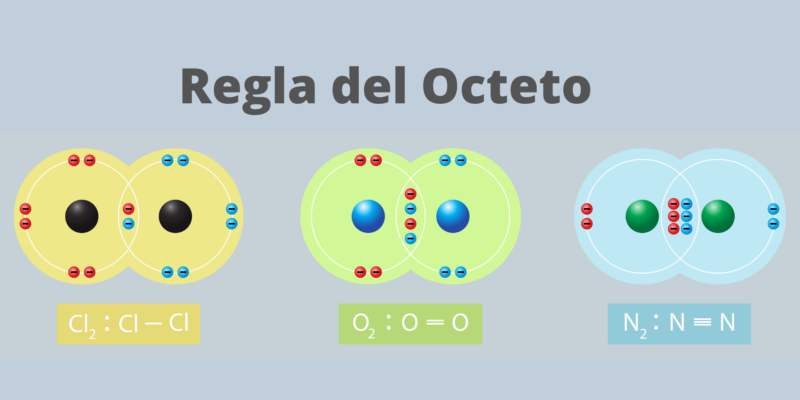

A “regra do octeto” foi formulado por Gilbert Lewis no início do século XX, para descrever a tendência dos átomos de se unirem para atingir uma camada eletrônica externa “completa” ou “fechada”, de acordo com sua valência (número de elétrons que um átomo deve aceitar ou abrir mão para completar sua última camada). Este princípio é o que rege as ligações covalentes.
Tal concha completa consistiria em oito (8) elétrons, então um átomo com valência 6 procuraria um par a mais e um átomo com valência 2 procuraria ter até seis a mais, pois nessa configuração o átomo goza de grande estabilidade, semelhante à dos gases nobres.
Diferenças com a ligação iônica (eletrovalente)
Enquanto a ligação covalente, como já foi dito, consiste em compartilhar pares de elétrons da camada externa dos átomos unidos, ligações iônicas consistem em transmitir ou emprestar um elétron entre um átomo e outro.
Para que isso ocorra, um dos dois átomos deve ceder um ou mais elétrons para o outro átomo. Assim, os átomos devem ser de um elemento metálico e de um elemento não metálico. Assim, formam-se íons carregados positivamente (cátions, provenientes do metal) e íons carregados negativamente (ânions, provenientes do ametal), que são atraídos eletrostaticamente para formar a ligação.
dipolo elétrico
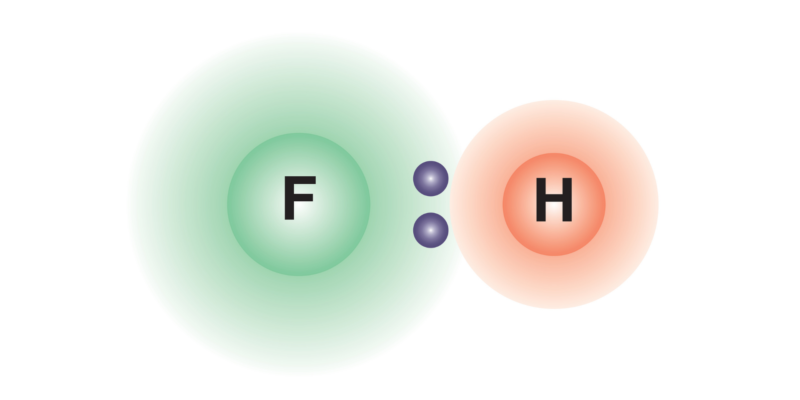

As ligações covalentes entre átomos de diferentes elementos químicos costumam produzir uma distribuição desigual da densidade de carga elétrica no composto químico formado, o que gera um dipolo elétrico (sistema de duas cargas de sinais opostos e de igual magnitude). Isso ocorre porque um átomo é mais eletronegativo que o outroassim atrairá os elétrons ligantes para si com maior força, gerando uma densidade de carga negativa sobre ele e positiva no outro átomo, o que leva à formação do dipolo.
Esta permite que moléculas covalentes se liguem a outras semelhantes e estruturas moleculares mais complexas são construídas.
Caso a ligação seja formada com átomos do mesmo elemento, a distribuição de cargas do composto químico formado será a mesma em toda a sua estrutura, portanto não deverá ser produzido um dipolo elétrico.
Polaridade
A polaridade é uma propriedade de compostos químicos que possuem uma distribuição não uniforme (desigual) de cargas em sua estrutura, por isso é intimamente relacionado com a formação de dipolos elétricos. De acordo com a presença ou ausência de polaridade, é possível distinguir entre ligações covalentes polares (que formam moléculas polares) e ligações covalentes apolares (que formam moléculas apolares ou apolares).
- ligações covalentes polares. Eles são produzidos entre átomos de elementos químicos diferentes e que possuem uma diferença de eletronegatividade maior que 0,5. Essas ligações formam o dipolo eletromagnético.
- Enlaces covalentes no polares o apolares. Eles são formados entre átomos do mesmo elemento químico, cuja eletronegatividade é a mesma. Eles também são formados entre átomos de elementos químicos diferentes, mas que possuem uma diferença de eletronegatividade muito pequena (menos de 0,4). Como a nuvem de elétrons é igualmente atraída por ambos os núcleos, o dipolo não é formado na molécula.
Tipos de ligação covalente
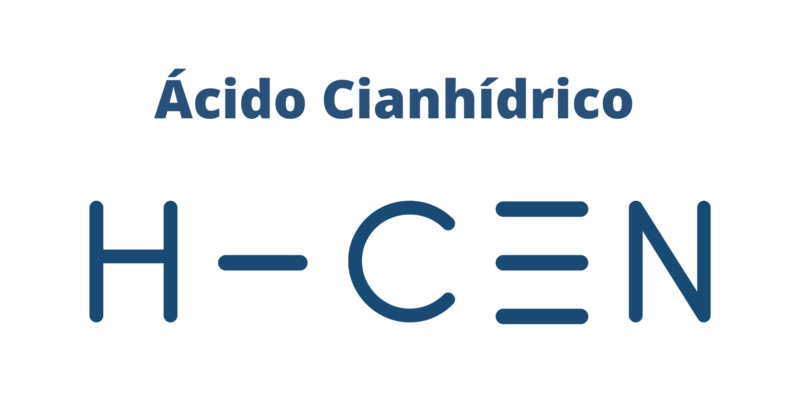

Existem os seguintes tipos de ligação covalente:
- Simples. Os átomos compartilham um par de elétrons em sua camada mais externa (um elétron de cada). Por exemplo: HH, H-Cl.
- duplo. Os átomos contribuem com dois elétrons cada, formando uma ligação dupla de quatro elétrons. Por exemplo: O=O, O=C=O.
- Triplo. Os átomos contribuem com três elétrons para formar três pares eletrônicos, ou seja, seis elétrons no total formando a ligação tripla. Por exemplo: N≡N.
- Dativo. Uma ligação covalente na qual um dos dois átomos contribui com dois elétrons e o outro nenhum. Por exemplo: NH4+.
quebra de ligações covalentes
Quando os átomos estão ligados covalentemente, eles tendem a liberar energia. Portanto, para quebrar a referida ligação é necessário suprir essa energia perdida, que irá variar de acordo com o tipo de átomos ligados e o tipo de ligação covalente formada. Assim, a energia de ligação é a energia total que é liberada quando um mol de ligações covalentes é formado e é a mesma que deveria ser aplicada para quebrar esse mol de ligações.
Por exemplo, para quebrar as ligações covalentes de 1 mol de moléculas de hidrogênio (H2)é necessário aplicar 104 quilocalorias/Kcal (435 quilojoules/kJ).
Tipos de substâncias covalentes
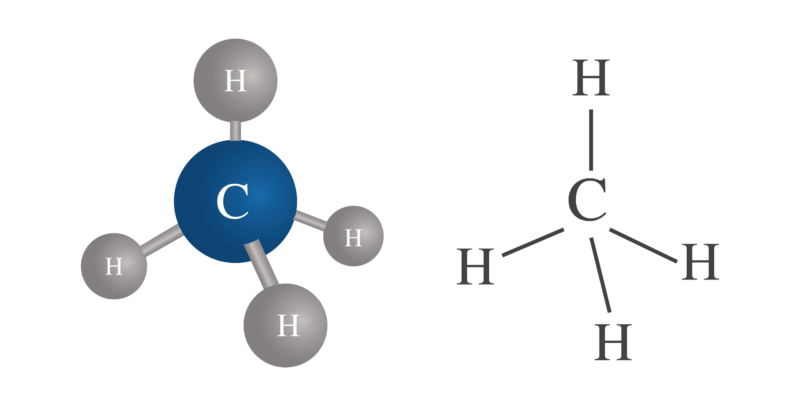

Substâncias cujos átomos possuem ligações covalentes podem ser de dois tipos:
- Moleculares. Formam moléculas com baixas temperaturas de fusão e ebulição, isolantes térmica e eletricamente, moles quando sólidas e solúveis em outras substâncias de polaridade semelhante (polar em polar e apolar em apolar). Por exemplo: oxigênio (O2).
- reticular. Formam redes cristalinas de átomos (semelhantes aos compostos iônicos) e possuem altas temperaturas de fusão e ebulição, dureza e solidez em condições normais de pressão e temperatura (1atm e 25°C), insolubilidade e são isolantes térmicos e elétricos. Por exemplo: quartzo.
valência atômica
A valência é o número de elétrons que um átomo deve ceder ou aceitar para completar sua camada mais externa. É uma informação essencial ao estudar ligações covalentes, pois nos diz quantos elétrons o átomo requer para alcançar a estabilidade.
esta valência pode variar dentro do mesmo átomo. Por exemplo, carbono (C) tem valência 4, hidrogênio (H) valência 1, mas enxofre (S) pode ter valência 2, 4 e 6.
Exemplos de Substâncias Polares e Apolares
De acordo com a polaridade das ligações covalentes que suas moléculas apresentam, podemos falar de compostos polares como:
- Metanol, fenol, acetona, ácido propiônico.
E substâncias apolares como:
- Cinco, tolueno, isobutano, n-Pentano.
Exemplos de Compostos Ligados Covalentemente
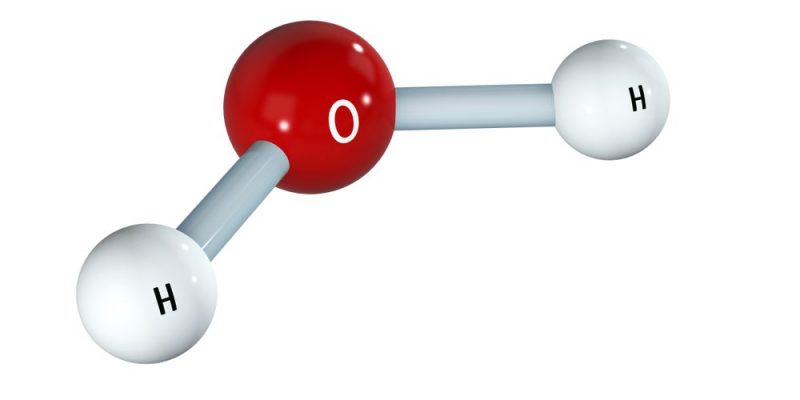

- Uma molécula de oxigênio (O2): O=O (enlace doble)
- Uma molécula de hidrogênio (H2): HH (enlace simples)
- Uma molécula de dióxido de carbono (CO2): O=C=O (ligações duplas)
- Uma molécula de água (H2O): HOH (links simples)
- Uma molécula de ácido clorídrico (HCl): H-Cl (ligações simples)
- Uma molécula de nitrogênio (N2): N≡N (enlace triplo)
- Uma molécula de ácido cianídrico (HCN): HC≡N (ligação simples e ligação tripla)
Pode te ajudar: Átomo de carbono