Explicamos o que são metais e não metais e as propriedades que possuem. Além disso, quais são suas características e exemplos.


O que são metais e não metais?
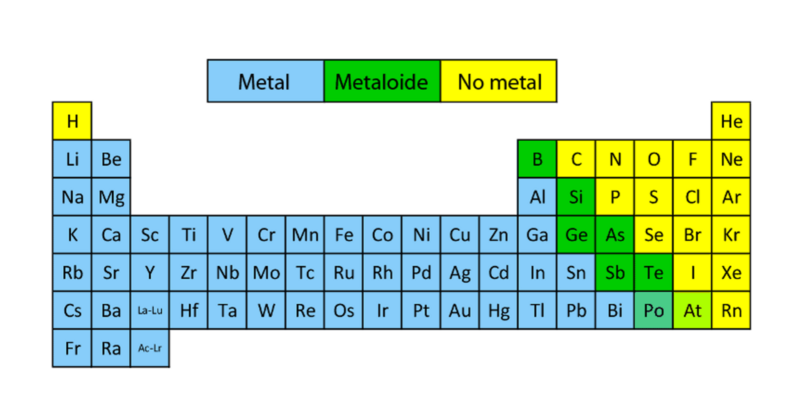
Da química eles se distinguem dois grupos de elementos de acordo com suas características e suas propriedades: metais e não metais.
A maioria dos elementos da tabela periódica são metais que estão presentes na crosta terrestre. O resto dos elementos, a minoria, são os não metálico e a maioria dos elementos deste grupo constituem a base para a formação de compostos orgânicos essenciais para a vida.
Esses dois grupos (que no total somam 118 elementos) estão localizados representados, organizados e classificados no tabela periódica. Os elementos de cada grupo são organizados de acordo com suas propriedades químicas, seu número de prótons (número atômico Z) e sua configuração eletrônica. Eles também são designados com símbolos, por exemplo, Fé para simbolizar o ferro (um metal) ou Ele para simbolizar o hélio (um não-metal).
Veja também: Metaloides
Características dos metais


Os metais são elementos químicos puros que Eles são caracterizados por serem sólidos à temperatura ambiente. (exceto mercúrio que é um metal líquido).
No entanto, as ligas que possuem caráter metálico também são consideradas metais. A fabricação de ligas envolve um processo no qual dois ou mais metais são misturados em seu estado natural.
Existem também ligas produzidas pela mistura de um metal e um não metal, como o aço, que é uma mistura de ferro (metal) e carbono (não metal) em determinadas proporções.
Algumas propriedades físicas dos metais são as seguintes:
- eles são maleáveis. Podem ser deformados em forma de chapa sem quebrar, por meio de golpes ou compressão. Por exemplo: ouro.
- eles são dúcteis. Eles podem ser manipulados e moldados em fios ou fios (especialmente ligas metálicas). Por exemplo: bronze.
- são motoristas. Eles transmitem eletricidade e calor. Por exemplo: a prata é o melhor condutor de eletricidade e o plutônio é o pior condutor de eletricidade.
- eles são resistentes. Devido à sua alta densidade, eles podem suportar forças de flexão, torção, compressão e tração sem quebrar, exceto para alguns metais frágeis, como bismuto (Bi) e manganês (Mn).
- eles são brilhantes. Devido à sua capacidade de brilhar e refletir a luz, é referido como “brilho metálico”.
Algumas propriedades químicas dos metais são as seguintes:
- Quase todos têm entre 1 e 3 elétrons na camada externa de cada átomo que os compõe.
- Perdem elétrons facilmente.
- Eles são corrosivos (isto é, desgastam-se ou enferrujam) em contato com a água.
- Possuem baixa eletronegatividade.
- Eles são alcalinos, alcalino-terrosos, transicionais, lantanídeos, actinídeos ou transactinídeos.
Alguns exemplos de metais são:
- Alcalinos. . . . Tais como césio (Cs), frâncio (Fr), lítio (Li), sódio (Na) e potássio (K).
- Alcalinotérreos. Tais como bário (Ba), cálcio (Ca), estrôncio (Sr), magnésio (Mg) e rádio (Ra).
- De Transição. Como cobre (Cu), cádmio (Cd), mercúrio (Hg), níquel (Ni) e prata (Ag).
- Lantánidos. Como cério (Ce), lantânio (La), gadolínio (Gd), térbio (Tb) e promécio (Pm).
- actinídeos. . . . Tais como amerício (Am), laurêncio (Lr), nobélio (No), urânio (U) e plutônio (Pu).
- Transactinídeos. . . . Tais como bohrium (Bh), hassio (Hs), muscovium (Mc), oganesson (Og) e rutherfordium (Rf).
Características dos não metais


Os não-metais são caracterizados por possuírem Aparências variadas entre gasoso, líquido e sólido. Por exemplo: gasoso como o hélio (He), macio como o enxofre (S) e duro como o diamante (C).
Algumas propriedades físicas de não-metais são as seguintes:
- Eles não são corrosivos.
- São maus condutores de eletricidade e calor.
- Eles são quebradiços, quebradiços, macios ou duros.
- Eles não são maleáveis.
- Eles não refletem a luz.
- Eles têm pontos de fusão mais baixos do que os dos metais.
Algumas de suas propriedades químicas de não-metais são as seguintes:
- Eles têm entre 4 e 8 elétrons em sua camada externa.
- Possuem alta eletronegatividade.
- São bons agentes oxidantes (formam óxidos ácidos).
- Eles formam ânions (ou seja, íons carregados negativamente).
- Vários não-metais são diatômicos (consistindo de dois átomos).
Alguns exemplos de não-metais são:
- Enxofre (S)
- Carbono (C)
- Cloro (Cl)
- Fósforo (P)
- Hélio (Ele)
- Nitrogênio (N)
- oxigênio (O)
- Iodo(I)
Continuar com: Vendas