Explicamos o que é o modelo atômico de Dalton, quais são suas principais características e suas limitações.


Qual é o modelo atômico de Dalton?
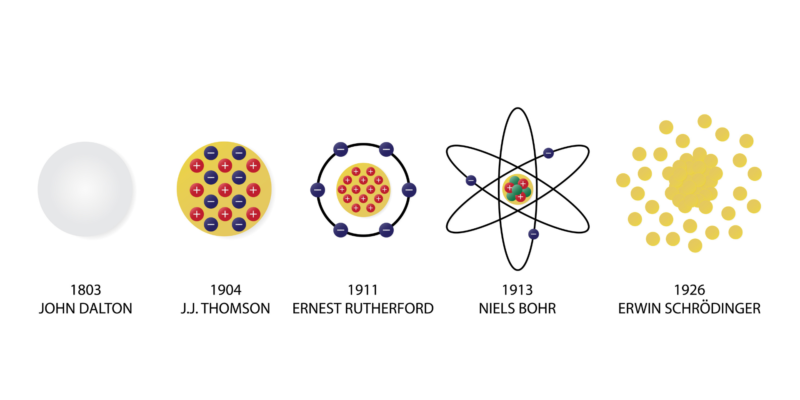
O modelo atômico de Dalton foi a primeira conceituação da função, estrutura e arranjo dos átomos. Foi criado entre 1803 e 1807 pelo cientista inglês John Dalton, que o chamou na época de “teoria atômica” ou “postulados atômicos”.
Esta elaboração teórica permitiu pela primeira vez explicar satisfatoriamente tanto a Lei das proporções constantes -que estabelece a proporcionalidade fixa entre as substâncias reagentes- como a Lei das proporções múltiplas -que afirma que as proporções entre as substâncias que participam de um reação química são sempre números inteiros. Além disso, permitiu explicar a existência de inúmeras substâncias elementares a partir de um conjunto finito de partículas constituintes.
O modelo atômico de Dalton é um modelo combinatório relativamente simples, que forneceu uma explicação para quase toda a química da época e que lançou as bases para futuros desenvolvimentos e inovações neste e em muitos outros campos da ciência.
Veja também: Modelo Atômico de Bohr
Postulados do modelo de Dalton

- primeiro postulado. O primeiro postulado da teoria de Dalton estabeleceu que toda a matéria é composta de partículas elementares chamadas “átomos” e que não podem ser divididas ou destruídas. Nem, de acordo com Dalton, eles podem ser criados ou alterados em qualquer reação química.
- segundo postulado. Os átomos de qualquer elemento são idênticos entre si, tanto em peso quanto em outras características; assim todos os átomos de oxigênio são necessariamente idênticos. Em vez disso, os átomos de diferentes elementos são diferenciados uns dos outros por seu peso. Deste postulado surgiu a noção de peso atômico relativo, ao comparar o de átomos diferentes com o de hidrogênio.
- terceiro postulado. Os átomos não podem ser divididos, não importa se eles se combinam como resultado de uma reação química. A combinação de átomos iguais ou diferentes vai gerar compostos ou substâncias mais complexas, mas sempre partindo do átomo como unidade fundamental mínima da matéria.
- quarto postulado. A combinação dos átomos de diferentes elementos pode formar diferentes compostos, dependendo das quantidades desses elementos. Por exemplo, peróxido de hidrogênio (H2O2) é composta por dois átomos de oxigênio e dois átomos de hidrogênio, enquanto a molécula de água é composta por um átomo de oxigênio e dois átomos de hidrogênio (H2QUALQUER). Ou seja, oxigênio e hidrogênio estão presentes nesses dois compostos químicos, mas em proporções diferentes.
- quinto postulado. Átomos de diferentes elementos podem se combinar em quantidades de dois ou mais para formar diferentes compostos químicos.
- sexto postulado. Os átomos não podem ser criados ou destruídos durante uma reação química.
- sétimo postulado. Quando os átomos se combinam para formar compostos químicos, eles o fazem em uma proporção numérica simples, nunca fracionária.
Virtudes do modelo Dalton

Existem muitas conquistas do modelo Dalton, que significou o início formal da química como a entendemos hoje. A teoria atômica abriu caminho para as questões da química dos séculos 18 e 19 e lançou as bases para a explosão subsequente (no século 20) que levaria, de mãos dadas com a tecnologia, a novas descobertas na compreensão da química. A teoria de Dalton era simples, eficaz e avançada para a época.
Limitações do modelo de Dalton


Era impossível para Dalton saber no século 19 o que o século 20 revelaria em termos de compreensão dos átomos, como o fato de que eles são feito de matéria menor eletricamente carregada: prótons, nêutrons e elétrons. Na verdade, os avanços na energia atômica mostraram que o átomo pode realmente se dividir e se fundir.
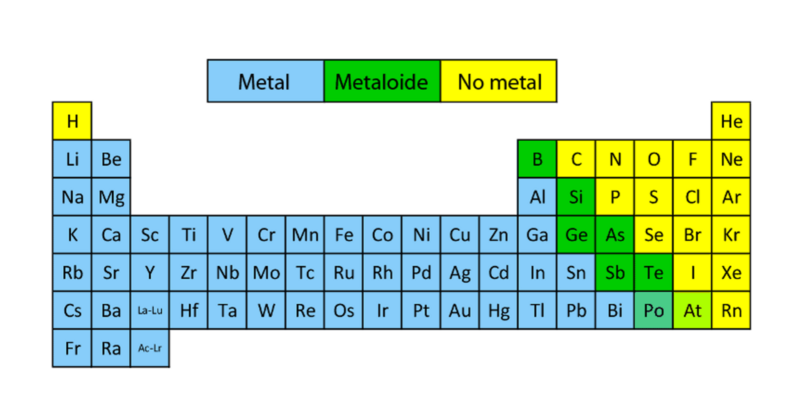
Outra grande limitação tinha a ver com falta de conhecimento de pesos atômicos, conforme estabelecido pela tabela periódica (mais tarde criada por Mandeleyev e Meyer) e suas regularidades periódicas e propriedades químicas específicas. Essa limitação se devia ao fato de Dalton acreditar que os compostos químicos eram formados com a menor quantidade possível de elementos, ou seja, que a água era formada por um átomo de oxigênio e um átomo de hidrogênio (HO) e não por um oxigênio e dois hidrogênios ( h)2O), como realmente é. Nem poderia explicar a existência de isótopos.
Por último, Dalton pensava que os gases eram necessariamente compostos de elementos simples e do mesmo tipo de átomos. Isso o levou a contradizer os resultados de Gay-Lussac sobre proporções volumétricas, que se mostraram comprovadamente verdadeiros.
Ancestrais do modelo Dalton
Houve postulados semelhantes na antiguidade, principalmente os dos filósofos gregos Leucipo de Mileto (século V a.C.) e seu discípulo Demócrito (século V – IV aC), que preferiu pensar as relações da matéria a partir da física e não da magia ou da vontade divina. No entanto, seus modelos atomísticos não eram baseados em observação e experimentação científica, mas em raciocínio lógico.
Outro antecessor foi os higgins irlandesesque propôs uma teoria semelhante, mas menos bem-sucedida em 1789.
modelos posteriores
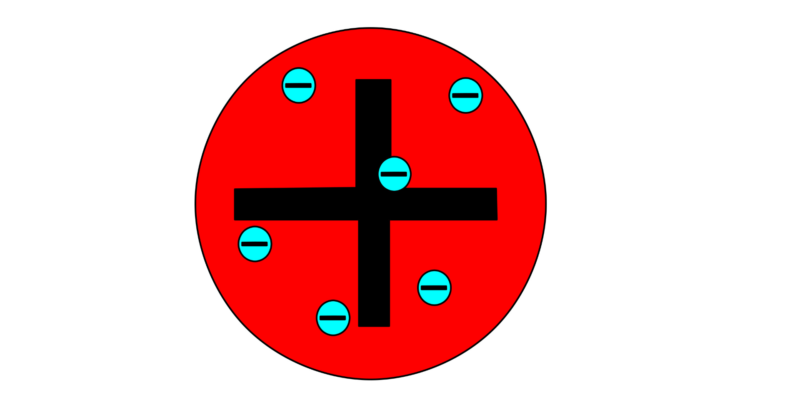

Outros modelos atômicos como Thompson’s (modelo conhecido como “The Raisin Pudding”) eles foram possíveis graças aos postulados de Dalton, embora sua indivisibilidade do átomo tenha sido contrariada pela descoberta do elétron no final do século XIX.
Em 1911, Rutherford propôs um modelo no qual o átomo é composto de um núcleo carregado positivamente contendo a maior parte da massa do átomo, ao redor do qual orbitam elétrons carregados negativamente.
Então, em 1913, Niels Bohr revelou um modelo no qual os elétrons orbitam um núcleo positivo, mas apenas em certas órbitas permitidas.
Esses modelos atômicos são seguidos por modelos mais modernos, mais específicos e mais próximos da realidade do átomo, mas isso tem sido possível graças aos avanços tecnológicos.
Continuar com: átomo de carbono