Explicamos o que são moléculas, como são classificadas e suas propriedades. Além disso, quais são suas características e exemplos.

O que são moléculas?
Molécula é chamada um conjunto de átomos eletricamente neutros, estruturados e inter-relacionados que pertencem ao mesmo elemento químico ou a vários. Por exemplo, a molécula de di-hidrogênio (H2) é composta apenas por átomos de hidrogênio, enquanto a molécula de metano (CH4) é formado por um átomo de carbono e quatro átomos de hidrogênio.
Esses conjuntos são formados graças a forças atrativas interatômicas chamadas ligações químicas, devido a que são formadas estruturas compostas de átomos que são mais estáveis do que os átomos sozinhos.
Outra maneira que tem sido usada para definir uma molécula, mas às vezes não é aceita por alguns cientistas, é que ela é a menor parte, que ainda mantém suas propriedades físicas e químicasEm que pode ser dividida uma substância química? Segundo essa definição, existem moléculas compostas por um único átomo, como o hélio (He).
As propriedades de uma substância específica são determinadas pelas propriedades das moléculas que compõe Portanto, a estrutura das moléculas de uma substância e a força das interações entre elas vai depender se ela é um sólido (pouca separação entre as moléculas), um líquido (separação média) ou um gás (muita separação).
Existem outros compostos químicos que também são compostos de conjuntos de átomos eletricamente neutros, mas não são moléculas. Entre eles estão os minerais que compõem a Terra, cristais iônicos (sais) ou covalentes e outros materiais semelhantes (como vidro ou metais). Ou seja, não se pode falar como tal de uma molécula de vidro, ferro ou alumínio.
Veja também: Alcenos
Como as moléculas foram descobertas?
A ideia de a matéria é feita de partículas indivisíveis unidas é tão antigo quanto a Grécia Antiga, quando o filósofo Demócrito o propôs.
Porém, a hipótese atômica em termos científicos só foi proposta em 1803quando o químico inglês John Dalton verificou que a matéria seria formada a partir de uniões estáveis de átomos chamados moléculas.
A natureza dos átomos e tais moléculas foi mais explorado por cientistas posteriores como Thompson e Rutherford, que lançaram as bases da química contemporânea.
A definição de uma molécula mudou à medida que a tecnologia avançou e um estudo mais detalhado da estrutura atômica e molecular tornou-se possível.
Tipos de moléculas

As moléculas podem ser classificadas de acordo com vários critérios. De acordo com o tamanho e complexidade de sua estrutura, eles são classificados como:
- Moléculas discretas. Eles têm um número definido de átomos, sejam de elementos diferentes ou do mesmo elemento, e podem ser classificados de acordo com o número de átomos em sua estrutura. Assim, temos monoatômico (um átomo), diatômico (dois átomos), triatômico (três átomos), tetraatômico (quatro átomos), etc. Por exemplo, dinitrogênio (N2) é uma molécula diatômica.
- Macromoléculas e Polímeros. São grandes cadeias moleculares, formadas por repetições de moléculas mais simples, ligadas entre si para alcançar sequências longas e complexas com propriedades novas e específicas. Essas macromoléculas são fundamentais para o desenvolvimento da química da vida. Por exemplo, DNA e proteínas.
É importante esclarecer que todos os polímeros são macromoléculas, mas nem todas as macromoléculas são polímeros. Polímeros são macromoléculas formadas por unidades moleculares mais simples chamadas monômeros, que se repetem ao longo de sua estrutura. Por outro lado, as macromoléculas são moléculas grandes que podem ou não ter uma unidade monomérica repetitiva.
De acordo com sua polaridade (separação de cargas na estrutura molecular), eles são classificados como:
- Moléculas polares. Eles são formados por átomos com diferentes eletronegatividades. Os elétrons derivam em direção ao átomo mais eletronegativo, criando uma densidade de carga negativa nele e uma densidade de carga positiva no outro átomo. Essa separação de cargas na molécula resulta na formação de um dipolo elétrico, ou seja, a molécula fica com uma certa carga elétrica. Por exemplo, água (H2O).
- Moléculas apolares. Seus átomos têm eletronegatividade idêntica, sem diferenças na atração dos elétrons pelos núcleos atômicos. Essas moléculas não possuem uma carga elétrica associada à distribuição desigual de seus elétrons. Por exemplo, o oxigênio molecular (O2).
De acordo com o elemento químico predominante em sua estrutura principal, são classificados como:
- moléculas orgânicas. Sua estrutura principal é baseada em átomos de carbono. Eles são essenciais para a vida. Por exemplo, metano (CH4) e aminoácidos (constituintes das proteínas).
- moléculas inorgânicas. Sua estrutura principal não é baseada em carbono. É importante esclarecer que também existem moléculas inorgânicas com átomos de carbono em sua estrutura, mas este não é seu elemento principal. Por exemplo, monóxido de carbono (CO) e amônia (NH3).
propriedades das moléculas

As principais propriedades das moléculas são:
- Polaridade. É a separação de cargas elétricas na estrutura molecular, pois os elétrons são mais atraídos pelos átomos mais eletronegativos. Essa propriedade é essencial para entender a solubilidade das substâncias, pois substâncias polares se dissolvem em substâncias polares, enquanto substâncias apolares se dissolvem em substâncias apolares, embora sempre haja pontos médios de polaridades.
- temperatura de fusão. A temperatura na qual um sólido se transforma em um líquido. Esta propriedade depende do tamanho da molécula.
- temperatura de ebulição. Temperatura na qual a pressão de vapor de um líquido se iguala à pressão ao redor do líquido, então o líquido se transforma em gás. Essa propriedade depende do tamanho da molécula, mas também de sua geometria e de suas interações com outras moléculas.
- Volume. As moléculas ocupam um certo volume no espaço.
- reatividade química. As moléculas são mais ou menos reativas dependendo dos átomos que as formam, da geometria de sua estrutura e das condições externas em que se encontram.
- isomeria. Duas moléculas têm isomerismo se tiverem a mesma quantidade de cada tipo de átomo, mas em cada uma delas esses átomos estão arranjados de maneira diferente. Ou seja, eles têm estruturas químicas diferentes, apesar de terem o mesmo número e tipo de átomos.
forças intermoleculares
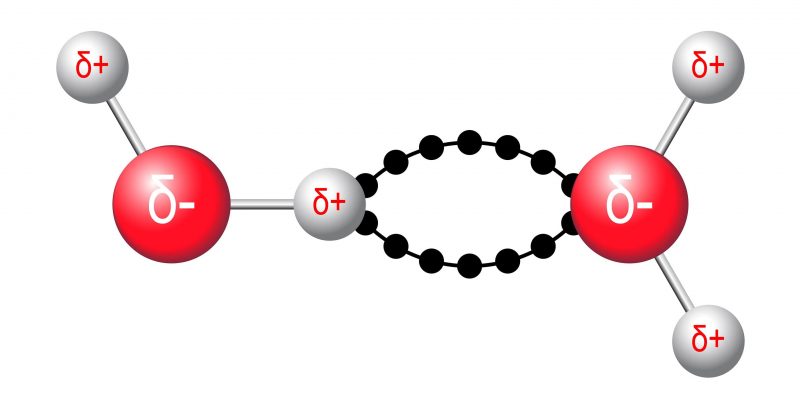
Forças intermoleculares são interações que ocorrem entre moléculas. Eles geralmente são baseados em suas polaridades e geometria. Essas forças podem ser de vários tipos:
Forças de Van der Waals:
- dipolo permanente – dipolo permanente. Eles ocorrem devido à atração eletromagnética entre duas moléculas polares.
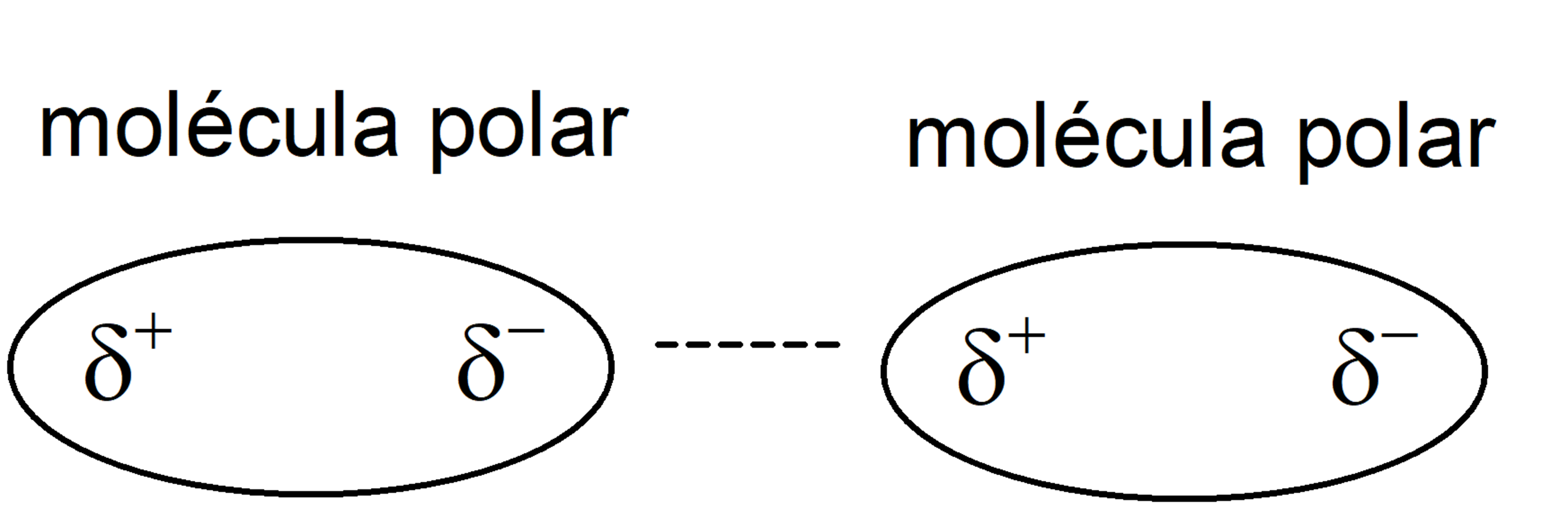
- Dipolo instantâneo – dipolo induzido. Chamadas de “forças de Londres”, são mais fracas e ocorrem entre todas as substâncias químicas, quando sua nuvem eletrônica é temporariamente desequilibrada em direção a uma extremidade da molécula, tornando-a capaz de atrair ou rejeitar as nuvens eletrônicas de outras moléculas próximas e transformá-las por indução em um dipolo momentâneo. Geralmente ocorrem entre moléculas apolares.
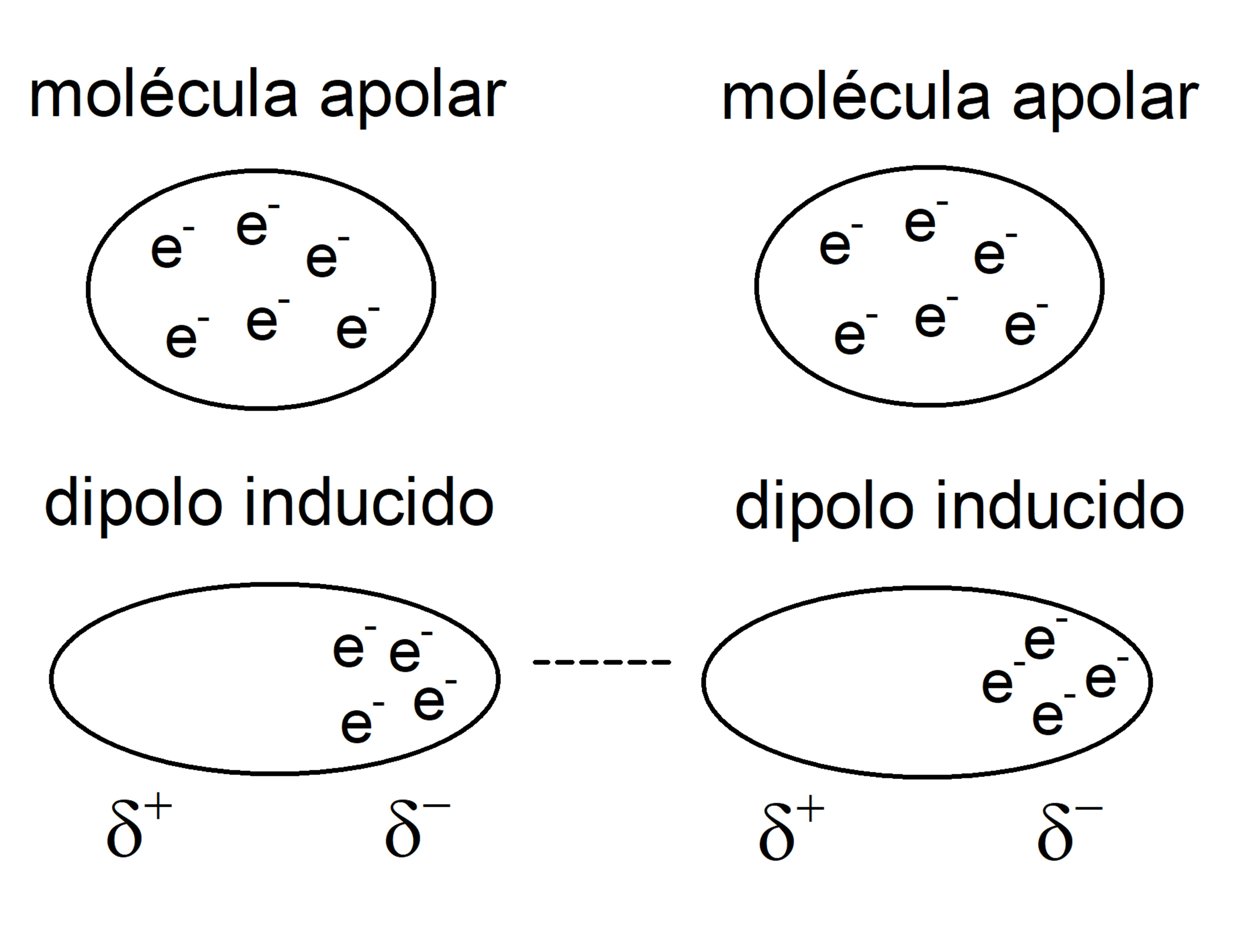
- dipolo – dipolo induzido. Eles ocorrem entre uma molécula polar e uma apolar. A densidade de carga da molécula polar distorce a densidade de carga da molécula apolar e induz um dipolo.

ligação de hidrogênio:
Alguns cientistas chamam esse tipo de força de ligação por ligação de hidrogênio, uma definição que às vezes é considerada errada. Mas independentemente de como é definido, é a interação eletrostática entre um átomo eletronegativo de uma molécula e um átomo de hidrogênio da outra.
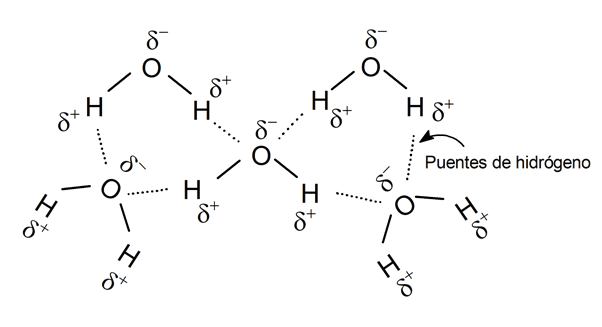
Diferenças entre íons e moléculas
Moléculas e íons diferem principalmente porque os últimos são unidades químicas eletricamente carregadas, enquanto as moléculas são neutras.
A perda ou ganho de elétrons de um átomo faz com que os íons se formem. Os íons podem ter uma carga elétrica positiva permanente. se os átomos perderem elétrons (cátions) ou negativos se ganharem elétrons (ânions). Por exemplo, o cátion sódio (Na+) e o ânion cloreto (Cl–).
Por causa dessa carga elétrica, a maneira como os íons reagem é muito diferente de como as moléculas o fazem.
Por outro lado, também existem íons poliatômicos, que são grupos de átomos que estão ligados por ligações covalentes, mas que em seu conjunto possuem carga elétrica. Por exemplo, o íon nitrato (NO3–).
estabilidade molecular

A estabilidade química das moléculas tem a ver com a energia contida em suas ligações químicas e com sua rede molecular.
Quanto mais energia a molécula tiver, mais reativa e menos estável ela será. Quebrar ligações químicas geralmente consome energia, e formá-las quase sempre libera energia.
É por isso que As moléculas tendem a ser mais estáveis do que seus átomos individuais.. E essa é também a razão pela qual os átomos tendem a se juntar a outros para formar moléculas.
Diferenças entre átomo e molécula
Moléculas são formadas por átomos ligados entre side modo que os átomos são muito menores e mais simples que as moléculas.
Moléculas maiores são formadas por moléculas mais simples. e minúsculas, que se tornam partes ou “grupos”.
Portanto, a maioria das moléculas pode ser submetido a vários procedimentos de quebra (lise) de suas ligações químicas, a fim de obter moléculas mais simples (se possível) ou átomos pertencentes a determinados elementos químicos.
exemplos de moléculas
Alguns exemplos de moléculas comuns são:
- Hidrogênio: H2
- Ácido clorídrico: HCl
- Dióxido de carbono: CO2
- Ácido sulfúrico: H2SO4
- Etanol: C2H5OH
- Ácido fosfórico: H3PO4
- Clorofórmio: CHCl3
- Glicose: C6H12O6
- Sacarose: C12H22O11
- Acetona: C3H6O
- Celulose: C6H10O5
- Amônia: NH3
Segue com: Compostos Orgânicos