Explicamos o que é o oxigênio, quando foi descoberto e quais são suas propriedades. Além disso, suas características, usos e muito mais.

O que é oxigênio?
O oxigênio (O) é um elemento químico não metáliconormalmente gasoso, extremamente abundante em nossa atmosfera (compõe 20,8% de seu volume atual) em sua forma molecular (O2) e o terceiro mais abundante no universo (depois do hidrogênio e do hélio). É essencial para a vida como a conhecemos, principalmente por sua capacidade de formar, juntamente com o hidrogênio, a molécula de água (H2O).
O nome oxigênio vem do grego antigo oxys (“ácido”) e -gonos (“produtor, gerador”), ou seja, significa “produtor de ácido” pois naqueles dias presumia-se erroneamente que os ácidos sempre continham oxigênio em sua estrutura química.
É muito reativo, então Não costuma ser encontrado em seu estado elementar (O)mas formando moléculas compostas por seus próprios átomos ou constituindo compostos químicos com outros elementos.
A molécula de oxigênio é geralmente diatômica (O2) à pressão e temperatura ambiente ou triatômica (ozônio O3) em condições ambientais específicas. Por exemplo, o O3 presente na estratosfera é formado quando os raios ultravioleta quebram o O2enquanto o O3 presente na troposfera é formado como resultado de reações fotoquímicas entre compostos orgânicos voláteis e óxidos de nitrogênio.
Como tem uma reatividade muito alta, átomos desse elemento são encontrados em inúmeros compostos orgânicos e inorgânicos do planeta, nos diversos estados de agregação da matéria. É, portanto, um elemento extremamente comum no mundo e no universo conhecido.
Veja também: ligação química
Oxigênio na Tabela Periódica
Na tabela periódica, o oxigênio está no início do grupo 16 (VIA)entre os elementos não metálicos conhecidos como anfigenes.
É representado pela letra O e nesse grupo é seguido por enxofre (S), selênio (Se), telúrio (Te), polônio (Po) e fígado (Lv).
O oxigênio tem número atômico 8 e é o segundo elemento mais eletronegativo da Tabela Periódica (o flúor é o mais eletronegativo). É um dos elementos que está em estado gasoso em condições de pressão e temperatura ambiente.
Quando foi descoberto o oxigênio?
Embora muitas de suas propriedades fossem conhecidas pelo estudo do ar desde os tempos antigos, o oxigênio como elemento foi descoberto em 1772 por Carl Wilhelm Scheele. Este farmacêutico sueco notou, enquanto queimava óxido de mercúrio, que “ar de fogo” era liberado.
Outros cientistas da época, como o clérigo britânico Joseph Priestley, fizeram a mesma descoberta em experimentos semelhantes e deram a ela o nome de “ar desflogisticado”.
Mais tarde, Antoine de Lavoisier dedicou-se ao estudo da combustão e oxidação, e descartou as teorias sobre o “flogisto”, que era uma suposta substância presente em todo combustível. Ao contrário, ele propôs a existência de um novo elemento químico: o oxigênio.
Em 1808, John Dalton elaborou sua teoria atômica., onde ele afirma que todos os elementos químicos são monoatômicos e compostos são formados usando a menor quantidade possível de cada elemento. Segundo essa teoria, a água tinha a fórmula HO (o que é um erro, a fórmula correta é H2O).
Então, em 1877, os físicos Raoul Pictet e Louis Paul Cailletet conseguiram obter oxigênio líquido, embora o montante obtido não seja suficiente para analisá-lo. Em 1891, o químico James Dewar conseguiu obter uma quantidade adequada de oxigênio líquido para estudos posteriores e em 1895 foi desenvolvido o primeiro método para produzi-lo com interesse comercial.
Propriedades químicas do oxigênio

oxigênio é um produto químico altamente reativo, capaz de formar compostos com quase todos os elementos conhecidos, exceto hélio (He) e neon (Ne). É o principal anfígeno (formador de ácidos e bases) e seus estados de oxidação são -2 e -1.
É um elemento que forma compostos inflamáveis e é muito reativo. Em contato com metais, forma óxidos e corrói as superfícies.
- Forma óxidos com metais alcalino-terrosos.

- O alumínio em pó queima violentamente na presença de oxigênio.
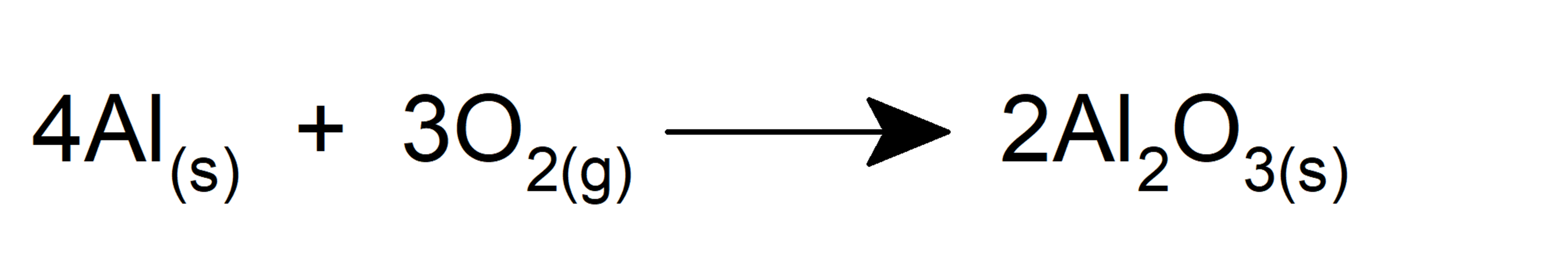
- Ele oxida o ferro para formar óxido de ferro (III).
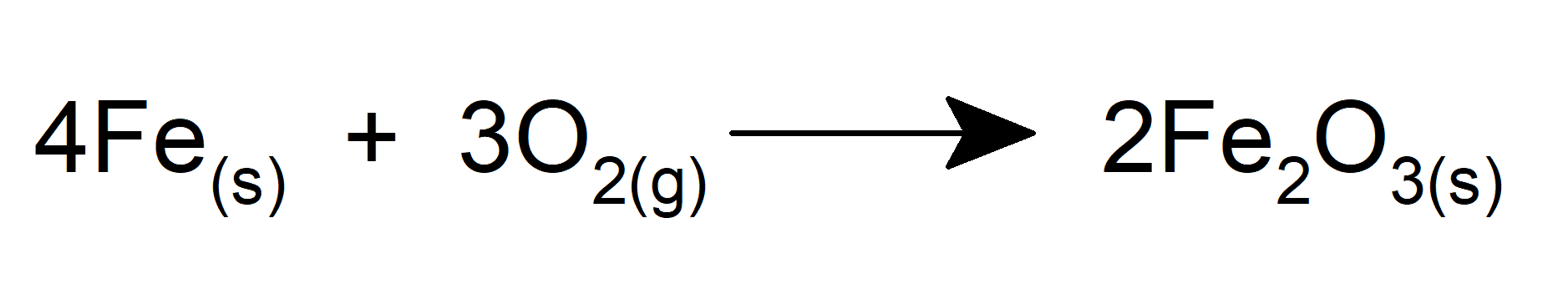
- Forma óxidos quando reage com o carbono.
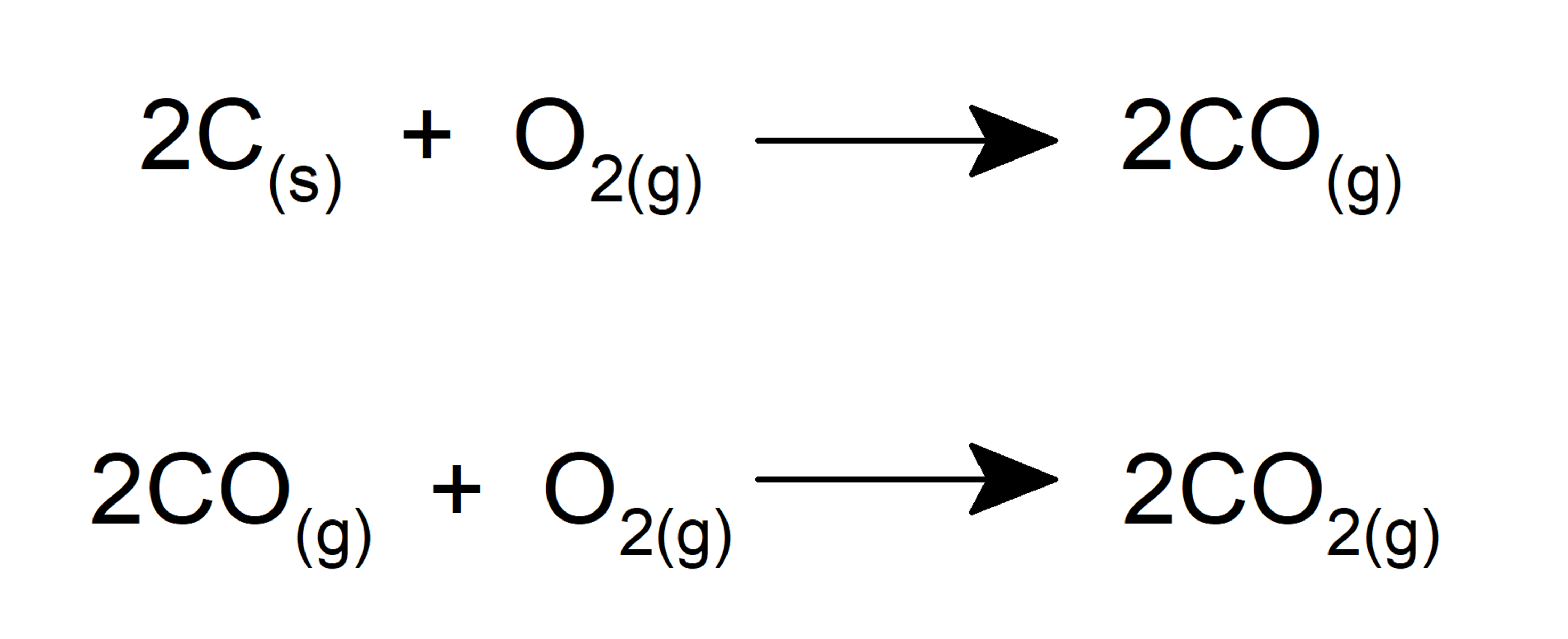
Propriedades físicas do oxigênio

Em condições normais de pressão e temperatura, o oxigênio manifesta-se como um gás incolor, inodoro e insípido. É muito mais solúvel em água do que o nitrogênio: a água doce contém cerca de 6,04 ml de oxigênio por litro, enquanto a água do mar contém 4,95 ml por litro.
Por outro lado, o oxigênio pode condensar (passar de gás para líquido) a -182,95 °C e congelar a -218,79 °C, tornando-se líquido e sólido, respectivamente, com uma leve coloração azul.
isótopos de oxigênio
O Oxigênio tem três isótopos naturais e estáveis: 16O, 17ou e 18Osendo o primeiro o mais abundante (99,762%).
Sabe-se que existem 14 isótopos radioativos de oxigênio, dos quais o mais estável é 15O.
Importância biológica do oxigênio
O Oxigênio é essencial na vida. Faz parte dos açúcares e aminoácidos que compõem as moléculas biológicas essenciais: carboidratos, proteínas, gorduras, etc. Além disso, constitui parte das moléculas essenciais para o transporte de energia no organismo dos seres vivos (ADP e ATP).
Por outro lado, o oxigênio é essencial para a fotossíntese nas plantas, algas e certas bactérias. Para realizar esse processo, esses organismos usam dióxido de carbono (CO2) do ar e da luz solar para transformar moléculas inorgânicas (como CO2 e água) em carboidratos, como a glicose. Por fim, o oxigênio é liberado no meio ambiente como produto dessa sequência de reações.
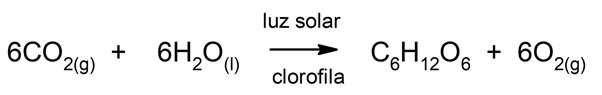
Graças a esse processo, há 2,5 bilhões de anos a atmosfera começou a se encher desse elemento. Muitas formas de vida anaeróbica na época foram eliminadas.
Pelo contrário, animais e outros seres vivos capazes de respirar precisamos de oxigênio atmosférico para quebrar as moléculas de glicose que obtemos dos alimentos. É assim que obtemos a energia de que precisamos para sobreviver.
Durante este processo, chamado de respiração, os organismos aeróbicos absorvem O2 do ar e liberar como um subproduto CO2.
![]()
usos de oxigênio
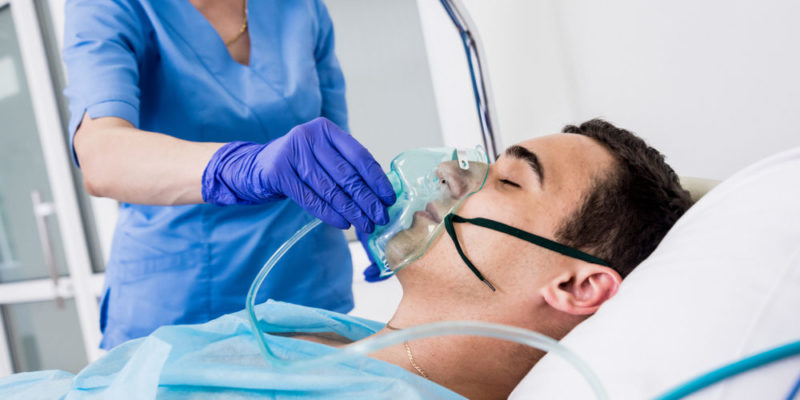
O oxigênio tem enormes aplicações em indústrias humanas, como:
- usos médicos. O oxigênio é usado como um gás respirável para manter vivos os pacientes cirúrgicos e como terapia (oxigenoterapia) para pacientes com problemas cardíacos e pulmonares, etc. Certos isótopos de oxigênio, como 15Ou tem sido usado para tomografia de pósitrons.
- suporte de vida. Em missões espaciais e subaquáticas, o oxigênio gasoso de baixa pressão é usado como gás respiratório para manter os níveis de habitabilidade de trajes, espaçonaves e alojamentos.
- usos industriais. 55% do oxigênio produzido no mundo em laboratórios vai para certas ligas de ferro, como o aço. Outros 25% vão para a indústria química, para criar óxido de etileno (C2H4O), base para o fabrico de inúmeros materiais têxteis e plásticos. Finalmente, o oxigênio também é usado para queimar acetileno e fazer maçaricos capazes de cortar metal muito rapidamente.
- Combustíveis e purificadores. O oxigênio também é usado para oxidar combustível de foguete, para tratamento de esgoto ou como ozônio (O3) para purificadores de água.
produção industrial de oxigênio
A produção industrial de oxigênio ocorre principalmente através de dois métodos:
- Filtragem de ar com zeólita. Este método consiste na passagem de ar limpo e isento de umidade por peneiras moleculares zeólitas que retêm o nitrogênio (N2) e deixe passar um ar cujo teor de oxigênio (O2) oscila entre 90 e 93%. Este método é usado para obter oxigênio em pequena escala.
- eletrólise da água. Este método consiste na decomposição da molécula de água em hidrogénio e oxigénio através da utilização de eletricidade: o ânodo (+) atrai as moléculas gasosas de oxigénio para um recipiente, e o cátodo (-) as de hidrogénio.
Compostos Inorgânicos de Oxigênio

O oxigênio, devido à sua alta eletronegatividade, reage com outros elementos para formar óxidos. Nos óxidos, o oxigênio tem estado de oxidação -2, enquanto nos peróxidos tem -1.
O composto inorgânico mais comum do oxigênio é a água (H2O), mas existem muitos óxidos nos quais um elemento metálico, não metálico ou metalóide é combinado com o oxigênio. Por exemplo: dióxido de silício (SiO2), presente na areia e no granito; alumina (Al2O3) presente na bauxita e corindo; óxido férrico (Fe2O3), em hematita e urina; etc.
compostos orgânicos de oxigênio
Em química orgânica, o oxigênio é um elemento comum como parte de macromoléculas complexas, como álcoois (R-OH), éteres (ROR), cetonas (R-CO-R)aldeídos (R-CO-H) e ésteres (R-COO-R) Por esta razão, muitos solventes orgânicos têm uma forte presença de oxigênio.
No entanto, a maioria dos compostos orgânicos com oxigênio, ao contrário dos inorgânicos, não é produzido por sua ação diretamas como parte de processos químicos mais complexos.
Riscos em seu uso

Oxigênio gasoso (O2) pode ser um agente tóxico no corpo humano quando está a uma pressão superior a 50 kPa. Este é o tipo de pressão a que estão sujeitos os mergulhadores de profundidade e os mergulhadores autônomos. Os sintomas de envenenamento por oxigênio incluem convulsões, lesões oculares, espasmos e danos neurológicos.
Por outro lado, sendo tão combustível, o gerenciamento de oxigênio em altas concentrações implica riscos de explosão ou incêndiouma vez que a molécula é propensa a combustão rápida.
Segue com: Metais Alcalinos








